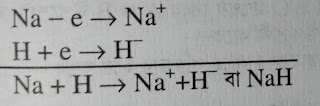হাইড্রোজেনের আয়নিক বন্ধন গঠনঃ
(H) হাইড্রোজেন পরমানু যখন ধাতুর সাথে যুক্ত থাকে তখন আয়নিক বন্ধন গঠন করে।
যেমনঃ NaH একটি আয়নিক যৌগ। এখানে Na = ধাতু
Na(11) = 1s² 2s² 2p⁶ 3s¹
H(1) = 1s¹
Na পরমানু শেষ কক্ষপথের ১টি ইলেকট্রন ত্যাগ করবে এবং ত্যাগকৃত ইলেকট্রন H পরমানু গ্রহন করবে। যেমনঃ
সুতরাং NaH যৌগে H পরমানু আয়নিক বন্ধন গঠন করে।
হাইড্রোজেনের সমযোজী বন্ধন গঠনঃ
H পরমানু যখন অধাতুর সাথে যুক্ত থাকে, তখন সমযোজী বন্ধন গঠন করে।
যেমনঃ HCl একটি সমযোজী যৌগ। এখানে Cl = অধাতু
H(1) = 1s¹
Cl(17) = 1s² 2s² 2p⁶ 3s² 3p⁵
এক্ষেত্রে H ও Cl তদের শেষ কক্ষপতের ইরেকট্রনগুলো পরস্পরের সঙ্গে শেয়ার করে সমযোজী বন্ধন গঠন করে।
সুতরাং HCl যৌগে H পরমানু সমযোজী বন্ধন গঠন করে।
বিঃদ্রঃ এখান থেকে আমরা বুঝতে পারি যে H পরমানু তার শেষ কক্ষপথের ১টি ইলেকট্রন শেয়ার করতে পারে আবার অন্য মৌল হতে ১টি ইলেকট্রন গ্রহন করতে পারে।