নবম দশম/এসএসসি রসায়ন দ্বিতীয় অধ্যায় পদার্থের অবস্থা এর পাঠ সম্পর্কিত গুরুত্বপূর্ণ সৃজনশীল প্রশ্ন ও উত্তর নিচে দেওয়া হলো।
এসএসসি রসায়ন ষষ্ঠ অধ্যায় মোলের ধারণা ও রাসায়নিক গণনা সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন -১ : নিচের চিত্রটি দেখে প্রশ্নগুলোর উত্তর দাও :

ক. মোল কাকে বলে?
খ. নাইট্রোজেন পরমাণুর যোজনী ও যোজ্যতা ইলেকট্রন ভিন্ন কেন? ব্যাখ্যা কর।
গ. উদ্দীপকের দ্রবণদ্বয়কে একত্রে মিশ্রিত করলে যে লবণ পাওয়া যায় তার সংযুতি নির্ণয় করে দেখাও।
ঘ. উদ্দীপকের দ্রবণ দুটির ঘনমাত্রা সমান হবে কিনা তার গাণিতিক যুক্তি দাও।
⇔ ১নং প্রশ্নের উত্তর ⇔
ক. কোনো রাসায়নিক পদার্থের যে পরিমাণে অ্যাভোগেড্রো সংখ্যক (৬.০২ × ১০২৩) অণু, পরমাণু বা আয়ন থাকে তাকে পদার্থের মোল বলে।
খ. নাইট্রোজেন মৌলের পারমাণবিক সংখ্যা ৭। এর ইলেকট্রন বিন্যাস নিম্নরূপ :
N(7) = 2, 5
= 1s22s22p 2p 2p
মৌলটির সর্বশেষ শক্তিস্তরে অর্থাৎ ২য় শক্তিস্তরে মোট ৫টি ইলেকট্রন থাকায় এর যোজ্যতা ইলেকট্রন ৫। আবার, মৌলটির সর্বশেষ শক্তিস্তরে তিনটি বেজোড় ইলেকট্রন বিদ্যমান। ফলে নাইট্রোজেন মৌলটি বন্ধন তৈরির সময় অন্য কোনো মৌলের তিনটি পরমাণুর সাথে যুক্ত হওয়ার ক্ষমতা রাখে। তাই নাইট্রোজেনের যোজনী ৩। অতএব, নাইট্রোজেন পরমাণুর যোজনী ও যোজ্যতা ইলেকট্রন ভিন্ন।
গ. উদ্দীপকের দ্রবণদ্বয় হলো HCl ও NaOH। HCl ও NaOH হলো এসিড ও ক্ষার। অতএব, এ দ্রবণদ্বয়কে একত্রে মিশ্রিত করলে প্রশমন বিক্রিয়ার মাধ্যমে এসিড ও ক্ষারের বিক্রিয়ায় সোডিয়াম ক্লোরাইড নামক লবণ ও পানি উৎপন্ন হয়। বিক্রিয়ার সমীকরণটি নিম্নরূপ :
HCl + NaOH = NaCl + H2O
NaCl লবণের সংযুতি নির্ণয় : সোডিয়ামের আপেক্ষিক পারমাণবিক ভর = ২৩ এবং ক্লোরিনের আপেক্ষিক পারমাণবিক ভর = ৩৫.৫।
NaCl এর আপেক্ষিক আণবিক ভর = ২৩ + ৩৫.৫
= ৫৮.৫
সুতরাং যৌগটিতে,
সোডিয়ামের সংযুতি = ২৩÷৫৮.৫ × ১০০% = ৩৯.৩২%
এবং ক্লোরিনের সংযুতি = ৩৫.৫÷৫৮.৫ × ১০০% = ৬০.৬৮%
∴ NaCl-এর শতকরা সংযুতি হচ্ছে Na = ৩৯.৩২% এবং Cl
= ৬০.৬৮%।
ঘ. উদ্দীপক থেকে দেখা যায় যে, ১০০ mL আয়তনের দুটি পৃথক পাত্রে ৪ম করে HCl ও NaOH রাখা হয়েছে। HCl ও NaOH এর আণবিক ভর যথাক্রমে ৩৬.৫ গ্রাম এবং ৪০ গ্রাম।
অর্থাৎ পাত্রে রাখা-
HCl এর পরিমাণ = ৪÷৩৬.৫ মোল = ০.১১ মোল
NaOH এর পরিমাণ = ৪÷৪০ মোল = ০.১ মোল
আমরা জানি, কোনো দ্রবণের ঘনমাত্রা প্রকাশের রীতিকে বলা হয় মোলারিটি। নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে দ্রবীভূত দ্রবের মোল সংখ্যাকে মোলারিটি বলে।
এখন, HCl দ্রবণের আয়তন = ১০০mL = ০.১L
∴HCl দ্রবণের ঘনমাত্রা = ০.১১০.১ মোল = ১.১M
আবার, NaOH দ্রবণের আয়তন = ১০০mL = ০.১L
∴NaOH দ্রবণের ঘনমাত্রা = ০.১০.১ মোল = ১.০M
সুতরাং দেখা যাচ্ছে যে, উদ্দীপকের দ্রবণ দুটির ঘনমাত্রা সমান হবে না।
প্রশ্ন -২ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
১০ গ্রাম CaCO3 প্রস্তুত করার লক্ষ্যে ৪.৪ গ্রাম কার্বন ডাইঅক্সাইড ও ৫ গ্রাম ক্যালসিয়াম অক্সাইড মিশ্রিত করা হলো। বিক্রিয়ায় প্রত্যাশিত উৎপাদ পাওয়া গেল না।
ক. রাসায়নিক সমীকরণ কাকে বলে?
খ. কার্বন ডাইঅক্সাইডের মোলার আয়তন ব্যাখ্যা কর।
গ. বিক্রিয়ায় কত মোল কার্বন ডাইঅক্সাইড ব্যবহার করা হয়েছিল তা নিরূপণ করে দেখাও।
ঘ. উদ্দীপকের বিক্রিয়ায় প্রত্যাশিত উৎপাদের পরিমাণ কম হওয়ার যৌক্তিক ব্যাখ্যা দাও।
⇔ ২নং প্রশ্নের উত্তর ⇔
ক. বিক্রিয়ক এবং উৎপাদ পদার্থের পরমাণুগুলোর মধ্যে সমতা বজায় রেখে প্রতীক ও সংকেতের সাহায্যে কোনো রাসায়নিক বিক্রিয়াকে সংক্ষেপে প্রকাশ করার পদ্ধতিকে রাসায়নিক সমীকরণ বলে।
খ. এক মোল পরিমাণ পদার্থের আয়তনকে মোলার আয়তন বলে। কার্বন ডাইঅক্সাইডের মোলার আয়তন বলতে এক মোল পরিমাণ CO2 এর আয়তনকে বুঝায়। কার্বন ডাইঅক্সাইডের আণবিক ভর = (১২ + ১৬ × ২) = ৪৪
∴ ১ মোল CO2 = ৪৪g
সুতরাং দেখা যাচ্ছে যে, CO2 এর মোলার আয়তন বলতে ৪৪ম কার্বন ডাইঅক্সাইড গ্যাসের আয়তনকে বোঝায়। প্রমাণ অবস্থায় ৪৪ম CO2 গ্যাসের মোলার আয়তন ২২.৪L।
গ. উদ্দীপকে সংঘটিত বিক্রিয়াটি হলো :
CaO + CO2 → CaCO3
CO2 এর আণবিক ভর =১২ + ১৬ × ২ = ৪৪
∴ CO2 এর ১ মোল = ৪৪ গ্রাম
দেওয়া আছে, বিক্রিয়ায় ৪.৪ গ্রাম CO2 মিশ্রিত করা হয়।
৪৪ গ্রাম CO2 = ১ mole
∴ ৪.৪ গ্রাম CO2 = (১ × ৪.৪)/৪৪ mole = ০.১ mole
অতএব, বিক্রিয়ায় ০.১ mole CO2 ব্যবহার করা হয়েছিল।
ঘ. প্রত্যাশিত উৎপাদ কম হওয়ার কারণ হলো ব্যবহৃত বিক্রিয়ক সঠিক পরিমাণে উপস্থিত না থাকা।
CaO + CO2 → CaCO3
১ মোল ১ মোল ১ মোল
আবার, ১ মোল CaCO3 = ৪০ + ১২ + (১৬ × ৩) = ১০০g
১ মোল CaO = ৪০ + ১৬ = ৫৬g
এবং ১ মোল CO2 = ১২ + (১৬ × ২) = ৪৪g
অর্থাৎ, ১০০ম CaCO3 প্রস্তুত করতে প্রয়োজন ৫৬g CaO
∴ ১g CaCO3 প্রস্তুত করতে প্রয়োজন = ৫৬÷১০০ g CaO
∴ ১০g CaCO3 প্রস্তুত করতে প্রয়োজন = (৫৬ × ১০)÷১০০ g CaO
= ৫.৬g CaO
একইভাবে, ১০০ম CaCO3 প্রস্তুত করতে প্রয়োজন ৪৪ম CO2
∴ ১g CaCO3 প্রস্তুতে প্রয়োজন = ৪৪÷১০০g CO2
∴ ১০g CaCO3 প্রস্তুতে প্রয়োজন = (৪৪ × ১০)÷১০০g CO2
= ৪.৪g CO2
অর্থাৎ ১০g CaCO3 প্রস্তুত করতে ৪.৪g CO2 প্রয়োজন এবং উদ্দীপকের বিক্রিয়ায় তা ব্যবহৃত হলেও প্রয়োজনীয় ৫.৬g CaO-এর স্থলে ৫g CaO ব্যবহৃত হয়েছে। ফলে ৪.৪ম CO2 সম্পূর্ণ বিক্রিয়ায় অংশগ্রহণ করতে পারেনি।
অতএব, প্রত্যাশিত উৎপাদ প্রস্তুতির লক্ষ্যে গৃহীত বিক্রিয়ক CaO এর ৫.৬ – ৫ = ০.৬ গ্রাম ঘাটতিই প্রত্যাশিত উৎপাদের পরিমাণ কম হওয়ার জন্য দায়ী।
প্রশ্ন -৩ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
১৮০ ভরবিশিষ্ট যৌগ M এর ৬.৭৫ম বিশ্লেষণ করে ০.৪৫g হাইড্রোজেন, ২.৭g কার্বন এবং ৩.৬g অক্সিজেন পাওয়া গেল।
ক. আণবিক সংকেত কাকে বলে? ১
খ. স্থুলসংকেত ও আণবিক সংকেতের মধ্যে দুইটি পার্থক্য লেখ। ২
গ. যৌগটির শতকরা সংযুতি নিণয় কর। ৩
ঘ. উক্ত ভরসমূহ ব্যবহার করে গ যৌগটির আণবিক সংকেত নির্ণয় করা সম্ভবÑগাণিতিক ব্যাখ্যা দাও। ৪
⇔ ৩নং প্রশ্নের উত্তর ⇔
ক. কোনো যৌগের অণুতে বিদ্যমান পরমাণুসমূহের প্রকৃত সংখ্যা প্রকাশকারী সংকেতকে আণবিক সংকেত বলে।
খ. স্থুল সংকেত ও আণবিক সংকেতের মধ্যে দুইটি পার্থক্য নিম্নে দেওয়া হলো-
| স্থুল সংকেত | আণবিক সংকেত |
| (i) যৌগের স্থুল সংকেত নির্ণয়ে এর সংযুতি জানা প্রয়োজন, কিন্তু আণবিক ভর জানার প্রয়োজন হয় না। | (i) যৌগের আনবিক সংকেত নির্ণয় করতে সংযুতির সাথে সাথে আণবিক ভর জানতে হয়। |
| (ii) যৌগের স্থুল সংকেত কোনো কোনো ক্ষেত্রে আণবিক সংকেতের সমান হয়। | (ii) যৌগের আণবিক সংকেত হয় এর স্থুল সংকেতের সমান অথবা কোনো সরল গুণিতকের সমান হয়। |
গ. উদ্দীপকের বিশ্লেষণ কার্যে ব্যবহৃত যৌগ গ-এর পরিমাণ = ৬.৭৫g
∴ হাইড্রোজেনের সংযুতি = ০.৪৫÷৬.৭৫ × ১০০ = ৬.৬৭%
∴ কার্বনের সংযুতি = ২.৭÷৬.৭৫ × ১০০ = ৪০%
∴ অক্সিজেনের সংযুতি = ৩.৬÷৬.৭৫ × ১০০ = ৫৩.৩৩%
ঘ. উক্ত ভরসমূহ ব্যবহার করে M যৌগটির স্থুল সংকেত নির্ণয় করা যায়।
উদ্দীপকের M যৌগের স্থুল সংকেত নির্ণয়ে নিচের ছকটি ব্যবহার করা হয়।
| বিষয় | হাইড্রোজেন (H) | কার্বন (C) | অক্সিজেন (O) | যৌগের স্থুল সংকেত |
| মৌলের শতকরা সংযুতি |
6.67 |
40 |
53.33 |
CH2O |
| মৌলের শতকরা সংযুতি |
= 6.67÷1 = 6.67 |
=40÷ 12 =3.33 |
53.33÷
16 = 3.33 |
|
| আপেক্ষিক পারমাণবিক ভর | ||||
| যৌগে C ও H পরমাণু সংখ্যার অনুপাত | (6.67 : 3.33 : 3.33) = 1 : 2 : 1 (পূর্ণ সংখ্যার অনুপাতের জন্য 3.33 দ্বারা ভাগ করে) | |||
অর্থাৎ M যৌগের স্থুল সংকেত = CH2O
আমরা জানি, কোনো যৌগের আণবিক সংকেত তার স্থুল সংকেতের যেকোনো সরল গুণিতক।
∴ M যৌগের আণবিক সংকেত = (CH2O)n
∴ M যৌগের আণবিক ভর = (১২ + ২ + ১৬) × n
= ৩০n
সুতরাং, ৩০n = ১৮০ [গ যৌগটির আণবিক ভর = ১৮০]
বা, n = ১৮০÷৩০
∴ n = ৬
∴ যৌগটির আণবিক সংকেত = (CH2O)৬
= C6H12O6
অতএব, প্রদত্ত গাণিতিক ব্যাখ্যা থেকে দেখা যায় যে, প্রদত্ত ভরসমূহ ব্যবহার করে M যৌগটির আণবিক সংকেত নির্ণয় করা সম্ভব।
প্রশ্ন -৪ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
১০gm ম্যাগনেসিয়ামকে ৫gm অক্সিজেনের সাথে মিশিয়ে উত্তপ্ত করা হলো। এতে প্রত্যাশিত উৎপাদ (১৫gm) পাওয়া গেল না।
ক. বিøচিং পাউডারের সংকেত লেখ। ১
খ. মৃৎক্ষার ধাতু বলতে কী বোঝায়? ২
গ. উদ্দীপকে ব্যবহৃত অক্সিজেনের অণু সংখ্যা নির্ণয় কর। ৩
ঘ. উদ্দীপকের বিক্রিয়ায় প্রত্যাশিত উৎপাদ তৈরি না হওয়ার কারণ বিশ্লেষণ কর। ৪
⇔ ৪নং প্রশ্নের উত্তর ⇔
ক. বিøচিং পাউডারের সংকেত Ca(OCl)Cl।
খ. পর্যায় সারণির গ্রæপ -২ এ অবস্থিত ইব থেকে শুরু করে জধ পর্যন্ত মৌলসমূহকে মৃৎক্ষার ধাতু (alkaline earth metal) বলা হয়। এদের ধর্ম অনেকটা ক্ষার ধাতুর ন্যায়।
মৃৎক্ষার ধাতুসমূহ সর্ববহিঃস্থ শক্তিস্তরের ২টি ইলেকট্রন অধাতুকে প্রদান করে আয়নিক যৌগ তৈরি করে। এদের অক্সাইডসমূহ পানিতে ক্ষারীয় দ্রবণ তৈরি করে। এই মৌলসমূহ বিভিন্ন যৌগ হিসেবে মাটিতে থাকে। এদের ধর্ম অনেকটা ক্ষার ধাতুর ন্যায়।
গ. উদ্দীপকে ৫ গ্রাম অক্সিজেন ব্যবহৃত হয়েছে।
আমরা জানি, অক্সিজেনের আণবিক ভর = ৩২gm
∴ ১ mole O2 = ৩২gm
আমরা জানি, কোনো পদার্থের এক মোলে ৬.০২ × ১০২৩ টি
অণু বা পরমাণু থাকে।
৩২gm অক্সিজেনের অণুর সংখ্যা ৬.০২ × ১০২৩ টি
∴ ৫gm ” ” ” (৬.০২ × ১০২৩ × ৫)÷৩২ টি
= ৯.৪১ × ১০২২ টি
∴ উদ্দীপকে ব্যবহৃত অক্সিজেনের অণুর সংখ্যা ৯.৪১ × ১০২২ টি।
ঘ. উদ্দীপকে সংঘটিত রাসায়নিক বিক্রিয়াটি হলো-
২Mg(s) + O2(g) → ২MgO(s)
১mol ম্যাগনেসিয়াম = ২৪gm ম্যাগনেসিয়াম
∴ ১০gm ম্যাগনেসিয়াম = (১ × ১০)/২৪ = ০.৪২ mol ম্যাগনেসিয়াম
আবার, ১mol অক্সিজেন = ৩২gm অক্সিজেন
∴ ৫gm অক্সিজেন = (১ × ৫)/৩২ = ০.১৫৬mol অক্সিজেন
উদ্দীপকের বিক্রিয়াটিতে ১mol অক্সিজেনের সাথে ২molMgO করে।
∴ ০.৪২mol ম্যাগনেসিয়ামের জন্য (০.৪২ ÷ ২) = ০.২১mol অক্সিজেন প্রয়োজন। কিন্তু এখানে মোট অক্সিজেনের পরিমাণ ০.১৫৬mol। অক্সিজেন তাই এখানে লিমিটিং বিক্রিয়ক। যেহেতু , বিক্রিয়ানুসারে ১ মোল অক্সিজেন থেকে ২ মোল ম্যাগনেসিয়াম অক্সাইড উৎপন্ন হয়। তাই অক্সিজেন এর মোলের দ্বিগুণ MgO-এর মোল হবে।
∴ MgO-এর মোলসংখ্যা = ০.৩১২ মোল = (২ × ০.১৫৬) মোল
আমরা জানি, MgO-এর এক মোল = ৪০gm
∴ MgO-এর ০.৪২ মোলের ভর = (৪০ × ০.৩১২) gm
= ১২.৪৮gm
এজন্য, প্রত্যাশিত ১৫gm MgO-এর স্থলে ১২.৪৮gm MgO উৎপন্ন হবে।
অতএব, অক্সিজেন লিমিটিং বিক্রিয়ক হওয়ায় বিক্রিয়ায় প্রত্যাশিত উৎপাদ তৈরি হয় না।
প্রশ্ন -৫ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
দশম শ্রেণির ছাত্র রাফিদ ল্যাবরেটরিতে উপযুক্ত পরিবেশে ৩০ গ্রাম নাইট্রোজেন গ্যাসের সাথে ২০ গ্রাম অক্সিজেন গ্যাস মেশালো। বিক্রিয়ার ফলে পাত্রে NO গ্যাস উৎপন্ন হলো।
ক. ধাতব বন্ধন কী? ১
খ. “উদ্দীপকের বিক্রিয়াটি সংশ্লেষণ বিক্রিয়া”- ব্যাখ্যা কর। ২
গ. উৎপন্ন গ্যাসটির ১০ গ্রামে মোট কতটি অণু বিদ্যমান? নির্ণয় কর। ৩
ঘ. রাফিদের নেয়া গ্যাস দুটির বিক্রিয়ার পর কোন বিক্রিয়ক কী পরিমাণে অবশিষ্ট থাকবে? বিশ্লেষণ কর। ৪
⇔ ৫নং প্রশ্নের উত্তর ⇔
ক. ধাতব পরমাণুসমূহ যে আকর্ষণ বল দ্বারা পরস্পরের সাথে আবদ্ধ থাকে, তাকে ধাতব বন্ধন বলে।
খ. যে বিক্রিয়ায় কোনো যৌগ তার উপাদান মৌলসমূহের প্রত্যক্ষ সংযোগে উৎপন্ন হয়, তাকে সংশ্লেষণ বিক্রিয়া বলা হয়।
উদ্দীপকে নাইট্রোজেন (N2) গ্যাস ও অক্সিজেন (O2) গ্যাসের সংযোগে নাইট্রোজেন মনোক্সাইড (NO) গ্যাস উৎপন্ন হয় সংশ্লেষণ বিক্রিয়ার মাধ্যমে। সকল সংশ্লেষণ বিক্রিয়া সংযোজন বিক্রিয়া। সুতরাং, উদ্দীপকের বিক্রিয়াটি সংশ্লেষণ বিক্রিয়া।
গ. উদ্দীপকে সংঘটিত রাসায়নিক বিক্রিয়াটি হলো-
N2(g) + O2(g) → ২NO(g)
উদ্দীপকে উৎপন্ন NO গ্যাসের আণবিক ভর = (১৪ + ১৬) = ৩০
∴ ১ mol NO গ্যাস = ৩০ gm
∴ উদ্দীপকে উৎপন্ন গ্যাসের পরিমাণ = ৬০ gm = ২ mol
আমরা জানি, যেকোনো গ্যাসের এক মোলে ৬.০২ × ১০২৩ টি অণু বিদ্যমান।
৬০gm NO গ্যাসে অণুর সংখ্যা (২ × ৬.০২ × ১০২৩) টি
∴ ১ gm NO ” ” ” (২ × ৬.০২ × ১০২৩)÷৬০ টি
∴ ১০ gm NO ” ” ” (২ × ৬.০২ × ১০২৩ × ১০)÷৬০ টি
= ২.০১ × ১০২৩ টি
∴ উৎপন্ন গ্যাসের ১০ গ্রামে অণুর সংখ্যা ২.০১ × ১০২৩ টি।
ঘ. উদ্দীপকে রাফিদদের ল্যাবরেটরিতে সংঘটিত রাসায়নিক বিক্রিয়াটি নিম্নরূপ-
N2(g) + O2(g) → ২NO(g)
২৮gm ৩২gm ৬০gm
আমরা জানি, ১ mol N2 = ২৮ gm
∴ ৩০ gm N2 = ৩০÷২৮ mol
= ০.৬৩ mol
বিক্রিয়াটি হতে দেখা যায় যে, ১ mol নাইট্রোজেন, ১ mol O2 এর সাথে বিক্রিয়া করে। সুতরাং, ১.০৭ mol নাইট্রোজেন, ০.৬৩ mol অক্সিজেনের সাথে বিক্রিয়া করে। অর্থাৎ এরপর আর অক্সিজেন অবশিষ্ট থাকে না। তাই, অবশিষ্ট নাইট্রোজেনের মোল সংখ্যা = (১.০৭ – ০.৬৩) mol = ০.৪৪ mol.
∴ নাইট্রোজেন অবশিষ্ট থাকে = ০.৪৪ mol
= (০.৪৪ × ২৮) gm
= ১২.৩২ gm
অতএব, রাফিদদের নেয়া গ্যাস দুটির বিক্রিয়ার পর নাইট্রোজেন বিক্রিয়কের ১২.৩২ gm অবশিষ্ট থাকবে।
এসএসসি রসায়ন ষষ্ঠ অধ্যায় সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন -৬ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
Zn(NO৩)২ Δ→ A(s) + B(g) + C(g) (ই যৌগিক গ্যাস)
ক. জীববিজ্ঞানে মোল শব্দ দ্বারা কী বুঝানো হয়? ১
খ. বিক্রিয়াটি পূর্ণ করে সমতা বিধান কর। ২
গ. ই এর ১০টি অণুর ভর নির্ণয় কর। ৩
ঘ. বিক্রিয়ায় উৎপন্ন গ্যাস দুটির মোলার আয়তন একই হবে কি? যুক্তিসহ বিশ্লেষণ কর। ৪
⇔ ৬নং প্রশ্নের উত্তর ⇔
ক. জীববিজ্ঞানে মোল শব্দ দ্বারা লোমবিশিষ্ট ক্ষুদ্র প্রাণ-কে বোঝায়।
খ. Zn(NO৩)২ (জিংক নাইট্রেট) কে উত্তপ্ত করলে জিংক অক্সাইড, নাইট্রোজেন ডাইঅক্সাইড ও অক্সিজেন গ্যাস উৎপন্ন হয়।
Zn(NO৩)২ Δ→ ZnO(s) + NO2(g) + O2(g)
বিক্রিয়ার সমীকরণে নাইট্রোজেন পরমাণুর সংখ্যা সমান করার জন্য উৎপাদ NO2-এর সাথে ২ দ্বারা এবং অক্সিজেন পরমাণুর সংখ্যা সমান করার জন্য উৎপাদ O2-এর সাথে ১/২ দ্বারা গুণন করা হয়। বিক্রিয়ার সমতাকৃত সমীকরণ নিম্নরূপ :
Zn(NO৩)২(s) Δ→ZnO(s) + ২NO2(g) + ১/২ O2(g)
গ. ‘খ’ থেকে দেখা যায় ই গ্যাসটি হলো নাইট্রোজেন ডাইঅক্সাইড (NO2)। এর আণবিক ভর =১৪ ×১ +১৬ × ২
= ১৪ + ৩২
= ৪৬
সুতরাং, NO2 এর ১ mole = ৪৬ gm
আমরা জানি, সকল গ্যাসের ১ mole-এ অ্যাভোগেড্রো সংখ্যার সমান সংখ্যক অর্থাৎ, ৬.০২ × ১০২৩ টি অণু থাকে।
অতএব, NO2 এর ৬.০২ × ১০২৩ টি অণুর ভর ৪৬ গ্রাম
∴ NO2 এর ১ টি অণুর ভর = ৪৬÷ (৬.০২ × ১০২৩) গ্রাম
∴ ১০ টি অণুর ভর = ৪৬ × ১০ ÷(৬.০২ × ১০২৩) গ্রাম
= ৭.৬৪ × ১০−২২ গ্রাম
সুতরাং, B এর ১০টি অণুর ভর হলো ৭.৬৪ × ১০−২২ গ্রাম।
ঘ. বিক্রিয়ায় উৎপন্ন গ্যাস দুটির মোলার আয়তন একই হবে। ‘খ’ থেকে দেখা যায়, প্রদত্ত বিক্রিয়ায় NO2 (নাইট্রোজেন ডাইঅক্সাইড) ও O2 (অক্সিজেন) দুটি গ্যাস উৎপন্ন হয়। এর মধ্যে B হলো NO2 যা একটি যৌগিক গ্যাস ও C হলো O2 যা একটি মৌলিক গ্যাস।
‘গ’ থেকে NO2 এর আণবিক ভর পাওয়া যায় ৪৬
∴ NO2 এর ১ mole = ৪৬gm
O2 এর আণবিক ভর = ১৬ × ২ = ৩২
∴ O2 এর ১ mole = ৩২ gm
আমরা জানি, এক মোল পরিমাণ পদার্থের আয়তনকে মোলার আয়তন বলে এবং প্রমাণ অবস্থায় যেকোনো গ্যাসীয় পদার্থের মোলার আয়তন ২২.৪ লিটার।
অর্থাৎ, ১ mole NO2 এর আয়তন ২২.৪ লিটার। আবার, ১ mole O2 এর আয়তনও ২২.৪ লিটার।
সুতরাং, প্রদত্ত বিক্রিয়ায় উৎপন্ন গ্যাস দুটির মোলার আয়তন একই হবে।
প্রশ্ন -৭ : নিম্নে একটি যৌগের শতকরা সংযুতি দেয়া হলো :
C = ৪০%, H = ৬.৬৭%, O= ৫৩.৩৩% এবং আণবিক ভর = ১৮০
ক. সংযুতি কাকে বলে? ১
খ. মৌলের যোজ্যতা বলতে কী বোঝ? ২
গ. উদ্দীপকের উল্লিখিত মৌলগুলোর শতকরা সংযুতি থেকে যৌগটির আণবিক সংকেত নির্ণয় কর। ৩
ঘ. উদ্দীপকের উল্লিখিত যৌগের শতকরা সংযুতি থেকে স্থুল সংকেত নির্ণয়ের নিয়মগুলো বিশ্লেষণ কর। ৪
⇔ ৭নং প্রশ্নের উত্তর ⇔
ক. যৌগের মোট ভরের মধ্যে কোনো নির্দিষ্ট মৌলের শতকরা ভরকে তার সংযুতি বলে।
খ. কোনো মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যত সংখ্যক ইলেকট্রন থাকে অথবা যত সংখ্যক বেজোড় ইলেকট্রন থাকে তাকে মৌলের যোজনী বা যোজ্যতা বলে। ধাতব মৌলের ক্ষেত্রে সর্বশেষ কক্ষপথের ইলেকট্রন সংখ্যা এবং অধাতব মৌলের ক্ষেত্রে সর্বশেষ কক্ষপথের বেজোড় ইলেকট্রন সংখ্যা মৌলের যোজ্যতা নির্দেশ করে।
অর্থাৎ যোজ্যতা মূলত কোনো মৌলের অন্য মৌলের সাথে যুক্ত হওয়ার সামর্থ্য বা ক্ষমতা।
গ. C, H ও O এর পারমাণবিক সংখ্যা যথাক্রমে ১২, ১ ও ১৬ সুতরাং
C পরমাণুর মোল সংখ্যা = ৪০÷১২ = ৩.৩৩
H পরমাণুর মোল সংখ্যা = ৬.৬÷১ = ৬.৬৭
O পরমাণুর মোল সংখ্যা = ৫৩.৩৩÷১৬ = ৩.৩৩
প্রাপ্ত ভাগফলগুলোকে এদের ক্ষুদ্রতম সংখ্যা অর্থাৎ ৩.৩৩ দ্বারা ভাগ করে-
C = ৩.৩৩÷৩.৩৩ = ১, H = ৬.৬৭÷৩.৩৩ = ২, O = ৩.৩৩÷৩.৩৩ = ১
সুতরাং গ্লুকোজ C, H এবং O পরমাণুর সংখ্যার অনুপাত
= ১: ২ : ১
অতএব, গ্লুকোজের স্থুল সংকেত বা সরল সংকেত = C1H2O1
= CH2O
গ্লুকোজের আণবিক সংকেত (CH2O)n হবে। যদি গ্লুকোজের আণবিক ভর ১৮০ হয়, তবে
(CH2O এর আণবিক ভর)n = ১৮০
বা, (১২ + ১ × ২ + ১৬)n = ১৮০
বা, n = ৬
সুতরাং, গ্লুকোজের আণবিক সংকেত = (CH2O)৬ = C6H12O6
ঘ. উদ্দীপকের উল্লিখিত যৌগের শতকরা সংযুতি থেকে স্থুল সংকেত নির্ণয়ের নিয়মগুলো হলো :
১. মৌলসমূহের শতকরা পরিমাণকে নিজ নিজ পারমাণবিক ভর দ্বারা ভাগ করে যৌগের অণুতে বিদ্যমান মৌলসমূহের মোল সংখ্যার অনুপাত বের করা হয়।
২. এ ভাগফলসমূহ যদি সরল ও পূর্ণ সংখ্যার না হয় তবে তাদেরকে তাদের মধ্যস্থিত ক্ষুদ্রতম সংখ্যা দ্বারা ভাগ করে মৌলসমূহের পরমাণু সংখ্যার অনুপাত বের করা হয়।
৩. দ্বিতীয় ভাগফলগুলো যদি পূর্ণসংখ্যা না হয়, তবে সুবিধাজনক ক্ষুদ্রতম সংখ্যা দ্বারা এদের প্রত্যেককে গুণ করে পূর্ণসংখ্যায় রূপান্তরিত করতে হবে। যদি কোনো ভাগফল বা গুণফল পূর্ণসংখ্যার কাছাকাছি হয়, তবে তার নিকটতম পূর্ণসংখ্যাকে গ্রহণ করতে হবে। এ পূর্ণসংখ্যাসমূহ হচ্ছে যৌগের স্থুলসংকেতে বিদ্যমান মৌলসমূহের স্ব স্ব পরমাণু সংখ্যার অনুপাত।
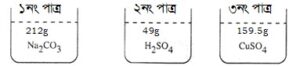
প্রশ্ন -৮ : নিচের চিত্রটি দেখে প্রশ্নগুলোর উত্তর দাও :

ক. অ্যাভোগেড্রো সংখ্যা কী? ১
খ. অ্যাভোগেড্রো সংখ্যা কিসের ওপর নির্ভর করে না? ব্যাখ্যা কর। ২
গ. ৩য় পাত্রে H পরমাণু এবং O পরমাণুর সংখ্যা নির্ণয় কর। ৩
ঘ. প্রমাণ তাপমাত্রা ও চাপে ১ম ও ২য় পাত্রের গ্যাসের আয়তন একই না ভিন্ন? তোমার উত্তরের পক্ষে যুক্তি দাও। ৪
⇔ ৮নং প্রশ্নের উত্তর ⇔
ক. কোনো বস্তুর ১ মোলে যত সংখ্যক অণু থাকে সেই সংখ্যাকে অ্যাভোগেড্রো সংখ্যা বলে।
খ. অ্যাভোগেড্রো সংখ্যা তাপমাত্রা ও চাপের ওপর নির্ভর করে না।
তাপমাত্রা ও চাপের পরিবর্তনের সঙ্গে গ্যাসের আয়তনের পরিবর্তন হয় কিন্তু ভর এবং অণু সংখ্যার কোনো পরিবর্তন হয় না।
গ. চিত্রের ৩য় পাত্রে রয়েছে H2O (পানি) যার ভর ১˙৮ গ্রাম। আমরা জানি, পানির আণবিক ভর = ১৮
∴ ১ মোল পানি = ১৮ গ্রাম পানি
১৮ গ্রাম পানির মধ্যে অণুর সংখ্যা ৬.০২ × ১০২৩ টি
∴ ১.৮ গ্রাম পানির মধ্যে অণুর সংখ্যা = (৬.০২ × ১০২৩ × ১.৮)÷১৮ টি
= ৬.০২ × ১০২২ টি
পানির একটি অণুর মধ্যে ২টি ঐ পরমাণু থাকে।
∴ ৬.০২ × ১০২২ সংখ্যক H2O এর অণুতে ঐ পরমাণুর সংখ্যা
= ৬.০২ × ১০২২ × ২ = ১২.০৪ × ১০২২ টি
আবার, ১টি H2O-এর অণুতে ১টি ঙ পরমাণু আছে।
অতএব ৬.০২ × ১০২২ সংখ্যক H2O অণুর মধ্যে ঙ পরমাণুর
সংখ্যা = ৬.০২ × ১০২২।
ঘ. দেয়া আছে,
১ম পাত্রে ৩.২ গ্রাম অক্সিজেন (O2)
এবং ২য় পাত্রে ২.৮ গ্রাম নাইট্রোজেন (N2)।
আমরা জানি,
O2 এর আণবিক ভর = ১৬ × ২ = ৩২
∴ O2 এর ১ mole = ৩২gm
N2 এর আণবিক ভর = ১৪ × ২ = ২৮
N2 এর ১ mole = ২৮gm
আবার, সকল গ্যাসের মোলার আয়তন সমান এবং প্রমাণ তাপমাত্রা ও চাপে তা হলো ২২.৪ Litre.
অর্থাৎ,
৩২ গ্রাম O2 এর আয়তন = ২২.৪ Litre.
∴ ১ গ্রাম O2 এর আয়তন = ২২.৪৩২ Litre.
∴ ৩˙২ গ্রাম O2 এর আয়তন = ২২.৪ × ৩.২৩২ Litre.
= ২.২৪ Litre.
এবং
২৮ গ্রাম N2 এর আয়তন = ২২.৪ Litre.
∴ ১ গ্রাম N2 এর আয়তন = ২২.৪২৮ Litre.
∴ ২.৮ গ্রাম N2 এর আয়তন = ২২.৪ × ২.৮২৮ Litre.
= ২.২৪ Litre.
দেখা যাচ্ছে যে, প্রমাণ তাপমাত্রা ও চাপে ১ম ও ২য় গ্যাসের আয়তন একই, ভিন্ন নয়।
প্রশ্ন -৯ : নিচের চিত্রগুলো লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
ক. মোলার দ্রবণ কী? ১
খ. ঘনমাত্রার সাথে মোলারিটি কীভাবে সম্পর্কিত? ২
গ. (১) নং পাত্রের যৌগটির মোলার দ্রবণ তৈরিতে প্রয়োজনীয় দ্রাবকের আয়তন বের কর। ৩
ঘ. “(৩) নং পাত্রের অণুর সংখ্যা (২) নং পাত্রের অণুর সংখ্যার দ্বিগুণ”- প্রতিপাদন কর। ৪
⇔ ৯নং প্রশ্নের উত্তর ⇔
ক. প্রতি লিটার দ্রবণে বা প্রতি ডে.মি.৩ দ্রবণে ১ মোল দ্রব দ্রবীভূত থাকলে সেই দ্রবণকে ওই দ্রবের মোলার দ্রবণ বলে।
খ. মোলারিটি হচ্ছে দ্রবণের ঘনমাত্রা প্রকাশের একটি রীতি।
নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে দ্রবীভূত দ্রবের মোল সংখ্যাকে দ্রবণের মোলারিটি বলে। অন্যদিকে, কোনো দ্রবণের একক আয়তনে কী পরিমাণ দ্রব দ্রবীভূত থাকে, তা দ্বারা ঐ দ্রবণের ঘনমাত্রা পরিমাপ করা হয়। অর্থাৎ, দ্রবণের ঘনমাত্রা পরিমাপ ও প্রকাশের সাথে মোলারিটি সম্পর্কিত।
গ. প্রতি লিটার দ্রবণে প্রদত্ত Na2CO3 এর এক মোল দ্রব থাকলে তবে এর মোলার দ্রবণ পাওয়া যাবে। দ্রবণ প্রস্তুত করার সময় বিভিন্ন ধরনের তরল পদার্থ যেমন- পানি, অ্যালকোহল, এসিড প্রভৃতি ব্যবহার করা হয়। এগুলোকে দ্রাবক বলে।
(১) নং পাত্রে, ২১২gNa2CO3¬ নেওয়া হচ্ছে।
Na2CO3 এর আণবিক ভর = (২৩ × ২ + ১২ + ১৬ × ৩)
= ১০৬
সুতরাং ১০৬ গ্রাম Na2CO3 = ১ মোল Na2CO3
ফলে, ২১২ গ্রাম Na2CO3 = (১ × ২১২)÷১০৬ মোল Na2CO3
= ২ মোল Na2CO3
যেকোনো যৌগের মোলার দ্রবণ তৈরি করার জন্য ওই যৌগের ১ মোল পরিমাণকে ১ লিটার বা ১০০০ মি.লি. দ্রবণে দ্রবীভূত করতে হয়।
সুতরাং, Na2CO3 এর মোলার দ্রবণ তৈরি করতে-
১ মোল দ্রব বা Na2CO3 এর জন্য দ্রাবক দরকার ১ লিটার
∴ ২ ” ” ” ” ” ” ” ১× ২ ”
= ২ লিটার।
সুতরাং, (১) নং পাত্রের যৌগ তথা ২১২ গ্রাম Na2CO3 এর মোলার দ্রবণ তৈরি করতে হলে ২ লিটার দ্রাবক দরকার হবে।
ঘ. মোল হিসাব করে তাতে অ্যাভোগেড্রো সংখ্যা অনুসারে অণুসংখ্যা নির্ণয় করা যায়। (২) ও (৩) নং পাত্রে যথাক্রমে ৪৯ গ্রাম H2SO4 এবং ১৫৯.৫ গ্রাম CuSO4 নেওয়া হয়েছে।
এখন, H2SO4 এর আণবিক ভর হচ্ছে = (১ × ২ + ৩২ + ১৬ × ৪)
= ৯৮
∴ ৯৮ গ্রাম H2SO4 = ১ মোল H2SO4
∴ ৪৯ ” ” =(১ × ৪৯)÷৯৮ মোল H2SO4
= ০.৫ মোল
আবার, CuSO4 এর আণবিক ভর = (৬৩.৫ + ৩২ + ১৬ ×৪)
= ১৫৯.৫
∴ ১৫৯.৫ গ্রাম CuSO4 = ১ মোল CuSO4
সুতরাং, (২) নং পাত্রে ০.৫ মোল (বা আধামোল) H2SO4 এবং (৩) নং পাত্রে, ১ মোল CuSO4 রয়েছে। আমরা জানি, যেকোনো পদার্থের এক মোলে অ্যাভোগেড্রো সংখ্যক (৬.০২ × ১০২৩) অণু থাকে।
সুতরাং (২) নং পাত্রে,
H2SO4 এর অণুর সংখ্যা = ০.৫ × NA = NA/২
এবং (৩) নং পাত্রে CuSO4 এর অণুর সংখ্যা = ১ × NA = NA
এখানে, NA দ্বারা অ্যাভোগেড্রোর সংখ্যাকে বোঝানো হয়েছে।
সুতরাং, বলা যায় (৩) নং পাত্রে অণুর সংখ্যা (২) নং পাত্রের অণুর সংখ্যার দ্বিগুণ।
প্রশ্ন -১০ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
২ লিটার ০.১ মোলার কপার সালফেট (CuSO4. ৫H2O) এর দ্রবণ প্রস্তুত করা হলো।
ক. দ্রব কী? ১
খ. প্রমাণ অবস্থায় ১ লিটার Cl২ গ্যাসের ভর নির্ণয় কর। ২
গ. উদ্দীপকের দ্রবণ প্রস্তুত করতে কত গ্রাম তুঁতে দরকার হবে? ৩
ঘ. উদ্দীপকের দ্রবণ এবং ৪৯.৯g H2SO4 যুক্ত সম আয়তন দ্রবণের ঘনমাত্রা সমান হবে কিনা গাণিতিক যুক্তি দেখাও। ৪
⇔ ১০নং প্রশ্নের উত্তর ⇔
ক. দ্রাবকের মধ্যে যে পদার্থ দ্রবীভ‚ত করে দ্রবণ প্রস্তুত করা হয়, তাকে দ্রব বলে।
খ. Cl এর পারমাণবিক ভর = ৩৫.৫
Cl২ এর আণবিক ভর = ৩৫.৫ × ২।
∴ এক মোল Cl২ = ৭১ গ্রাম
আমরা জানি, প্রমাণ অবস্থায় যেকোনো গ্যাসীয় পদার্থের এক মোলের আয়তন সমান এবং এই মান ২২.৪ লিটার।
অর্থাৎ, ২২.৪ লিটার Cl২ গ্যাসের ভর ৭১ গ্রাম
∴ ১ লিটার Cl২ গ্যাসের ভর = ৭১÷২২.৪ গ্রাম
= ৩.১৭ গ্রাম
সুতরাং, প্রমাণ অবস্থায় ১ লিটার Cl২ গ্যাসের ভর ৩.১৭ গ্রাম।
গ. তুঁতে বা কপার সালফেট (CuSO4. ৫H2O) এর আণবিক ভর
= (৬৩.৫ × ১ + ৩২ ×১ + ১৬ × ৪) + ৫(১ × ২ +১৬ ×১)
= (৬৩.৫ + ৩২ + ৬৪) + ৫(২ +১৬)
= ১৫৯.৫ + (৫ × ১৮)
= ২৪৯.৫
সুতরাং ১ mole CuSO4. ৫H2O = ২৪৯.৫gm
∴ ০.১ mole CuSO4. ৫H2O = ২৪৯.৫ × ০.১gm
= ২৪.৯৫gm
১ লিটার ০.১গ দ্রবণ প্রস্তুত করতে ২৪.৯৫gm তুঁতে দরকার
∴ ২ লিটার ০.১গ দ্রবণ প্রস্তুত করতে = ২৪.৯৫ × ২gm তুঁতে দরকার
= ৪৯.৯gm
অতএব, উদ্দীপকের দ্রবণ প্রস্তুত করতে ৪৯.৯gm তুঁতে দরকার হবে।
ঘ. উদ্দীপকের দ্রবণের ঘনমাত্রা নির্ণয় :
‘গ’ থেকে পাই
২৪৯.৫gm = ১ mole CuSO4. ৫H2O
∴ ২৪.৯৫gm = ১ × ২৪.৯৫২৪৯.৫ mole CuSO4. ৫H2O
= ০.১ mole
অর্থাৎ,
২ লিটার দ্রবণে দ্রবীভ‚ত মোলসংখ্যা ০.১ mole
∴ ১ লিটার দ্রবণে দ্রবীভ‚ত মোলসংখ্যা ০.১২ mole
= ০.০৫ mole
সুতরাং, উদ্দীপকের দ্রবণের ঘনমাত্রা = ০.০৫ গ
আবার, ৪৯.৯gm H2SO4 যুক্ত সমআয়তন দ্রবণের ঘনমাত্রা নির্ণয় :
H2SO4 এর আণবিক ভর = ১ × ২ + ৩২ × ১ +১৬ × ৪
= ২ + ৩২ + ৬৪
= ৯৮
∴ ৯৮gm H2SO4 = ১ mole H2SO4
∴ ৪৯.৯gm H2SO4 = ৪৯.৯৯৮ mole
= ০.৫০৯ mole
অর্থাৎ,
২ লিটার দ্রবণে দ্রবীভ‚ত দ্রবের মোলসংখ্যা ০.৫০৯ mole
∴ ১ লিটার দ্রবণে দ্রবীভ‚ত দ্রবের মোলসংখ্যা ০.৫০৯২ mole
= ০.২৫ mole
সুতরাং, ৪৯.৯ম H2SO4 যুক্ত দ্রবণের ঘনমাত্রা ০.২৫গ
অতএব, দেখা যাচ্ছে যে, উদ্দীপকের দ্রবণ এবং ৪৯.৯ম H2SO4 যুক্ত দ্রবণের ঘনমাত্রা সমান হবে না।
প্রশ্ন -১১ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
শাওন ও রিমি একত্রে পরীক্ষাগারে ২ লিটার ০.১ মোলার (গ) তুঁতে প্রস্তুত করল। তারা H2SO4 এর একটি ২ লিটারের প্রস্তুতকৃত দ্রবণ দেখতে পেল। সুমাইয়া ভর মেপে দেখল উক্ত H2SO4 এর ভর ৪৯.৯ম।
ক. সেমিমোলার দ্রবণ কাকে বলে? ১
খ. কেলাস পানি বলতে কী বোঝায়? ২
গ. শাওন ও রিমি কত গ্রাম তুঁতে প্রস্তুত করেছিল? ৩
ঘ. উদ্দীপকের দ্রবণ দুটির ঘনমাত্রা সমান হবে কিনা তার গাণিতিক যুক্তি দাও। ৪ ৪
প্রশ্ন -১২ : নিচের সমীকরণ দুটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
(i) H2 + O2 ¾→ 2H2O
(ii) CaCO3 → CaO + CO2
ক. অ্যাভোগেড্রো সংখ্যার মান কত? ১
খ. ১ গ্রাম কার্বনে কতটি কার্বন পরমাণু আছে? ২
গ. (র) নং বিক্রিয়ায় ৫৪ গ্রাম H2O উৎপন্ন করতে কত গ্রাম অক্সিজেনের প্রয়োজন হবে? ৩
ঘ. “উদ্দীপকের (রর) নং বিক্রিয়ায় ৮০ গ্রাম চুনাপাথরকে উত্তপ্ত করে ৩৯ গ্রাম CaO পাওয়া গেল”। উৎপাদের শতকরা পরিমাণ হিসাব কর। ৪
প্রশ্ন -১৪ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
আবদুল্লাহ ১.৫ম কার্বনকে বাতাসে (অক্সিজেনে) দহন করে প্রমাণ তাপমাত্রা ও চাপে ী লিটার CO2 উৎপন্ন করল। অপরদিকে বাবলু ১শম চুনাপাথর (CaCO3) কে উত্তপ্ত করে প্রমাণ তাপমাত্রা ও চাপে ু লিটার CO2 উৎপন্ন করল।
ক. মৌলের সংযুতি নির্ণয়ের সূত্রটি কী? ১
খ. সমীকরণটি সমতা কর : Al2O3 (s) + HCl (aq) ¾→ AlCl3(s) + H2O(l)
ঘ. ১.৫ম কার্বন ও ১.৫ম অক্সিজেন থেকে কত লিটার ঈঙ২ উৎপন্ন হবে? ৪