নবম দশম/এসএসসি রসায়ন ১০ম অধ্যায় সৃজনশীল প্রশ্ন ও উত্তর নিচে দেওয়া হলো। সেই সাথে ১০ম অধ্যায় সৃজনশীল প্রশ্নব্যাংক দেওয়া হলো।
এসএসসি রসায়ন ১০ম অধ্যায় সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন -১ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
ক্যালামাইনের তাপজারণে উৎপন্ন ZnS কে চিত্রের ন্যায় রিটর্টে নিয়ে জিংক ধাতু আহরণ করা হয়। উৎপন্ন ধাতুকে তড়িৎ বিশ্লেষণের সাহায্যে আরেও বিশুদ্ধ করা হয়।

ক. ক্যালামাইনের রাসায়নিক সংকেত লিখ।
খ. তাপজারণের ব্যাখ্যা দাও।
গ. রিটর্টে সংঘটিত মূল বিক্রিয়াটি ব্যাখ্যা কর।
ঘ. উদ্দীপকের ধাতু কেবল তড়িৎ বিশ্লেষণ প্রক্রিয়ায় নিষ্কাশন না করে তিন ধাপে করার কারণ মূল্যায়ন কর।
⇔ ১নং প্রশ্নের উত্তর ⇔
ক. ক্যালামাইনের রাসায়নিক সংকেত ZnCO3।
খ. তাপজারণ হলো আকরিক থেকে ধাতু নিষ্কাশনের একটি ধাপ।
ঘনীকৃত আকরিককে অক্সাইডে রূপান্তরের সময় যেসব পদ্ধতি অবলম্বন করা হয় সেগুলোর মধ্যে তাপজারণ একটি। সাধারণত সালফাইড আকরিকের তাপজারণ করা হয়। সালফাইড আকরিককে বায়ু প্রবাহের উপস্থিতিতে গলনাঙ্ক তাপমাত্রার নিম্ন তাপমাত্রায় উত্তপ্ত করা হয়। খনিজমল যেমন : সালফার, আর্সেনিক, ফসফরাস ইত্যাদি উদ্বায়ী অক্সাইডরূপে দূরীভূত হয়।
২ZnS (জিংক বেøন্ড) + ৩O2 –→ ২ZnS + ২SO2
২PbS (গ্যালেনা) + ৩O2 –→ ২PbO + ২SO2
গ. রিটর্টে সংঘটিত মূল বিক্রিয়াটি হলো কার্বন বিজারণ বিক্রিয়া।
রিটর্টের মধ্যে রাখা রাসায়নিক পদার্থসমূহ হচ্ছে জিঙ্ক অক্সাইড (ZnS) এবং কোক তথা কার্বন (ঈ)।
রিটর্টের মধ্যে নিম্নরূপ বিক্রিয়া সংঘটিত হয় :
ZnO(s) + C(s) -→ Zn(s) + CO(g)
এই বিক্রিয়ায় কার্বন বিজারণ পদ্ধতিতে ধাতুর অক্সাইডের সাথে কোক যোগ করে বিজারণের মাধ্যমে ধাতুকে মুক্ত করা হয়েছে। অর্থাৎ ZnS কার্বন দ্বারা বিজারিত হয়ে Zn ধাতুর বাষ্প এবং কার্বন মনোক্সাইড উৎপন্ন হয়। সুতরাং, রিটর্টে সংঘটিত মূল বিক্রিয়াটি হলো কার্বন বিজারণ বিক্রিয়া।
ঘ. Zn মধ্যম সক্রিয় ধাতু বলে কেবল তড়িৎ বিশ্লেষণ প্রক্রিয়ায় ধাতু নিষ্কাশন না করে তিন ধাপে করা হয়।
উচ্চ সক্রিয় ধাতুসমূহকে তড়িৎ বিশ্লেষণ দ্বারা মুক্ত করা হয়। সক্রিয়তা সিরিজে ক থেকে Al পর্যন্ত ধাতুগুলো অত্যন্ত সক্রিয় বলে এদের প্রকৃতিতে মুক্ত অবস্থায় পাওয়া যায় না এবং এদের তড়িৎ বিশ্লেষণের মাধ্যমে মুক্ত করা হয়। অপরদিকে, Mn, Zn, Cr, Fe মধ্যম সক্রিয় ধাতু। এদের কার্বন বিজারণ পদ্ধতিতে মুক্ত করা হয়।
যেহেতু, Zn একটি মধ্যম সক্রিয় ধাতু, তাই নিম্নোক্ত তিন ধাপে Zn ধাতু নিষ্কাশন করা হয়।
i. ঘনীকৃত আকরিককে অক্সাইডে রূপান্তর
ii. ধাতব অক্সাইডকে মুক্ত ধাতুতে রূপান্তর
iii. ধাতু বিশোধন
বিক্রিয়াগুলো নিম্নরূপ-
২ZnS(s) + ৩O2(g) -→ ২ZnS(s) + ২SO2(g) [তাপজারণ]
ZnO(s) + C(s) -→ Zn (s) + CO (g) [কার্বন বিজারণ]
প্রশ্ন -২ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
একটি খনিতে বক্সাইট ও ক্যালামাইন মিশ্রিত কিছু খনিজের অস্তিত্ব পাওয়া গেল। ড. টমাসের নেতৃত্বে একদল রসায়নবিদ উক্ত খনিজ থেকে দুটি ভিন্ন পদ্ধতিতে ধাতু দুটি নিষ্কাশন করলেন।
ক. খনিজ কাকে বলে?
খ. “সকল খনিজই আকরিক নয়” ব্যাখ্যা কর।
গ. দ্বিতীয় আকরিকটির বিযোজনে প্রাপ্ত অক্সাইডদ্বয়ের প্রকৃতি ব্যাখ্যা কর।
ঘ. ভিন্ন পদ্ধতিতে ধাতু দুটি নিষ্কাশনের কারণ যুক্তিসহ লিখ।
⇔ ২নং প্রশ্নের উত্তর ⇔
ক. ভ‚পৃষ্ঠে বা ভ‚গর্ভে কোনো কোনো শিলাস্তূপে প্রচুর পরিমাণ যৌগ অথবা মুক্ত মৌল হিসেবে যেসব মূল্যবান ধাতু বা অধাতু পাওয়া যায়, সেগুলোকে খনিজ বলে।
খ. ভ‚পৃষ্ঠে বা ভ‚গর্ভের কোনো কোনো শিলাস্তূপে জমাকৃত যৌগ বা মুক্ত মৌলই হলো সংশ্লিষ্ট যৌগ বা মৌলের খনিজ।
অন্যদিকে, আকরিক বলতে বোঝায় যেগুলো থেকে লাভজনকভাবে ধাতু নিষ্কাশন করা যায়। অর্থাৎ একটি মৌলের বা যৌগের সকল খনিজ আকরিক নাও হতে পারে। কেবল লাভজনক হলেই আকরিক বলা হয়। তাই বলা যায় সকল খনিজই আকরিক নয়।
গ. উদ্দীপকে উল্লিখিত দ্বিতীয় আকরিকটি হচ্ছে ক্যালামাইন। ক্যালামাইন হলো Zn-এর একটি আকরিক যার রাসায়নিক সংকেত হচ্ছে ZnCO3।
ZnCO3 উত্তাপে নিম্নোক্তরূপে বিযোজিত হয় :
ZnCO3(s) ZnS(s) + CO2(g)
উপর্যুক্ত সমীকরণ থেকে দেখা যায় যে, ক্যালামাইনের বিযোজনে যে দুটি অক্সাইড পাওয়া যায় তা হলো জিঙ্ক অক্সাইড (ZnS) এবং কার্বন ডাইঅক্সাইড (CO2)। জিঙ্ক অক্সাইড সাদা পাউডার জাতীয় পদার্থ। অন্যদিকে, কার্বন ডাইঅক্সাইড গ্যাস। ZnS উভধর্মী এবং CO2 অম্লধর্মী।
কারণ, জিংক অক্সাইড এসিড ও ক্ষারক উভয়ের সাথে বিক্রিয়া করে লবণ ও পানি তৈরি করে।
ZnS + ২HCl = ZnCl২ + H2O
ZnS + ২NaOH = Na২ZnS২ + H2O
সোডিয়াম জিংকেট
কার্বন ডাইঅক্সাইড (CO2) পানির সাথে বিক্রিয়া করে কার্বনিক এসিড (H2CO3) উৎপন্ন করে।
CO2 + H2O -→ H2CO3
সুতরাং, দ্বিতীয় আকরিকটির বিযোজনে প্রাপ্ত জিংক অক্সাইড (ZnS) উভধর্মী এবং কার্বন ডাইঅক্সাইড (CO2) অম্লধর্মী অক্সাইড।
ঘ. ভিন্ন পদ্ধতিতে ধাতু দুটি নিষ্কাশনের কারণ হলো ধাতু দুটির সক্রিয়তার ভিন্নতা।
ধাতু নিষ্কাশনের দুটি ভিন্ন পদ্ধতি রয়েছে। যথা : (র) কার্বন বিজারণ ও (রর) তড়িৎ বিশ্লেষণ। কার্বন বিজারণ পদ্ধতিতে ধাতব অক্সাইডের সাথে কোক তথা কার্বন (ঈ) মিশিয়ে উত্তপ্ত করার মাধ্যমে ধাতুকে মুক্ত করা হয়। সাধারণত মধ্যম সক্রিয় ধাতু যেমন : Mn, Zn, Cr, Fe প্রভৃতি ধাতুর বেলায় এই পদ্ধতি অবলম্বন করা হয়। আবার, তড়িৎ বিশ্লেষণ পদ্ধতিতে সংশ্লিষ্ট আকরিকের গলিত দ্রবণের মধ্যে তড়িৎ প্রবাহ চালনা করে ধাতুকে মুক্ত করা হয়। সাধারণত অধিক সক্রিয় ধাতুসমূহের ক্ষেত্রে এই পদ্ধতি অবলম্বন করা হয়। উদ্দীপকে উল্লিখিত খনিজ দুটি হলো বক্সাইট ও ক্যালামাইন। এরা যথাক্রমে অ্যালুমিনিয়াম (Al) এবং জিঙ্ক (Zn) এর খনিজ। Zn হলো মধ্যম সক্রিয় ধাতু। তাই কার্বন বিজারণ পদ্ধতিতে ক্যালামাইন থেকে নিম্নোক্ত পদ্ধতিতে Zn ধাতু নিষ্কাশন করা হয় :
ZnCO3 –→ ZnS + CO2
২ZnS + C -→ ২Zn + CO2
অন্যদিকে Al একটি সক্রিয় ধাতু, তাই তড়িৎ বিশ্লেষণের মাধ্যমে নিম্নোক্তভাবে বক্সাইট থেকে Al ধাতু নিষ্কাশন করা হয়-
Al২O3(aq) -→ ২Al৩+(aq) + ৩O2-
ক্যাথোডে : অ্যালুমিনিয়াম আয়ন ইলেকট্রন গ্রহণ করে অ্যালুমিনিয়ামে বিজারিত হয়।
Al৩+ + ৩e- -→ Al
অ্যানোডে : অক্সাইড আয়ন ইলেকট্রন ত্যাগ করে অক্সিজেনে পরিণত হয়।
O2- -→ O + ২e-
O + O-→ O2
সুতরাং, উপরের আলোPbা তুলনামূলক বিশ্লেষণ করলে দেখা যায় যে, ধাতুদ্বয়ের সক্রিয়তার ভিন্নতার কারণেই ভিন্ন পদ্ধতিতে ধাতু দুটি নিষ্কাশনের মূল কারণ।
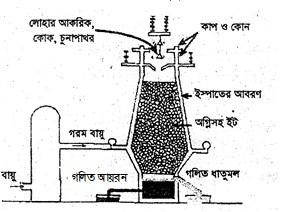
প্রশ্ন -৩ : নিচের চিত্রটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
ক. ব্রাস কী? ১
খ. Al ধাতু প্রকৃতিতে যৌগ হিসেবে থাকে কেন? ২
গ. চুল্লিতে সংঘটিত বিক্রিয়াসমূহ লেখ। ৩
ঘ. বিক্রিয়ার উৎপাদ, আর কারো সাথে বিক্রিয়া করতে পারে কিনা? তোমার মতামত বিশ্লেষণ কর। ৪
⇔ ৩নং প্রশ্নের উত্তর ⇔
ক. ব্রাস হলো ৩৫% Cu এবং ৬৫% Zn এর সংকর।
খ. Al ধাতু রাসায়নিকভাবে অত্যন্ত সক্রিয় এবং তীব্র তড়িৎ ধনাত্মক মৌল। সহজেই অন্য মৌল বা যৌগের সাথে বিক্রিয়া করে। প্রকৃতিতে কখনো মুক্ত অবস্থায় পাওয়া যায় না। এজন্য Al ধাতু প্রকৃতিতে যৌগ হিসেবে অবস্থান করে।
গ. চুল্লিতে সংঘটিত বিক্রিয়াসমূহ হলো :
হেমাটাইট + কার্বন মনোঅক্সাইড = ম্যাগনেটাইট + কার্বন ডাইঅক্সাইড
৩Fe২O3 + CO = ২Fe৩O4 + CO2
ম্যাগনেটাইট + কার্বন মনোঅক্সাইড = ফেরাস অক্সাইড + কার্বন ডাইঅক্সাইড
Fe৩O4 + CO = ৩FeO + CO2
ফেরাস অক্সাইড + কার্বন মনোঅক্সাইড = আয়রন + কার্বন ডাইঅক্সাইড
FeO + CO = Fe + CO2
ক্যালসিয়াম কার্বনেট = ক্যালসিয়াম অক্সাইড + কার্বন ডাইঅক্সাইড
CaCO3 = Cao + CO2
ক্যালসিয়াম অক্সাইড + সিলিকা = ক্যালসিয়াম সিলিকেট
Cao + SiO2 = CaSiO3
ঘ. বাত্যাচুল্লিতে আয়রন নিষ্কাশনের সময় মধ্যবর্তী উৎপাদ ফেরাস অক্সাইড (FeO), এসিডিক ফ্লাক্স যেমন : SiO2 এর সাথে বিক্রিয়া করতে পারে। এতে করে ফেরাস অক্সাইড (FeO), সিলিকন ডাইঅক্সাইডের (SiO2) সাথে বিক্রিয়া করে অদ্রবণীয় ফেরাস সিলিকেট (FeSiO3) ধাতব মল উৎপন্ন করে।
FeO+SiO2→FeSiO3 (অদ্রবণীয় ধাতব মল)
এক্ষেত্রে FeO হচ্ছে ক্ষারকীয় অক্সাইড। আয়রন নিষ্কাশনে যদি FeO অধিক ক্ষারকীয় অক্সাইড বিদ্যমান থাকে তবে FeO আর SiO2 এর সাথে সিলিকেট গঠন করে না। ফলে ধাতুমল হিসেবে আয়রনের অপচয় হয় না। এজন্য চুল্লিতে চুনাপাথর দেওয়া হয়।
এতে করে চুনাপাথর (CaCO3) উত্তাপে বিযোজিত হয়ে ক্যালসিয়াম অক্সাইড (Cao) উৎপন্ন করে। এটি FeO অপেক্ষা অধিক ক্ষারকীয়। এটি SiO2 এর সাথে বিক্রিয়া করে ধাতব সিলিকেট তৈরি করে।
CaCO3 –→ Cao + CO2
Cao + SiO2 –→ Ca SiO3
প্রশ্ন -৪ : নিচের চিত্রটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :

ক. বক্সাইট কী? ১
খ. অ্যালুমিনা হতে কার্বন বিজারণ পদ্ধতিতে অ্যালুমিনিয়াম ধাতু নিষ্কাশন করা যায় না কেন? ২
গ. কীভাবে গ ধাতুটি নিষ্কাশন করা হয় ব্যাখ্যা কর। ৩
ঘ. গ ধাতুর অক্সাইডের তড়িৎ বিশ্লেষণকালে অ্যানোডে অক্সিজেন ও কার্বন ডাইঅক্সাইড এবং ক্যাথোড বা ধাতু উৎপন্ন হওয়ার যৌক্তিক কারণ ব্যাখ্যা কর। ৪
⇔ ৪নং প্রশ্নের উত্তর ⇔
ক. বক্সাইট হলো অ্যালুমিনিয়ামের একটি আকরিক যার সংকেত Al২O3 .২H2O।
খ. Al-এর আকরিক Al২O3-কে কার্বন বিজারণ পদ্ধতিতে মুক্ত করা যায় না, কারণ Al হচ্ছে উচ্চ সক্রিয় ধাতু।
উচ্চ সক্রিয় ধাতুসমূহকে তড়িৎ বিশ্লেষণ দ্বারা মুক্ত করা হয়। সক্রিয়তা সিরিজের ক থেকে Al পর্যন্ত ধাতুগুলো অত্যন্ত সক্রিয় বলে এদের প্রকৃতিতে মুক্ত অবস্থায় পাওয়া যায় না এবং এদের তড়িৎ বিশ্লেষণের মাধ্যমে মুক্ত করা হয়। তাই অ্যালুমিনা (Al২O3) থেকে অ্যালুমিনিয়াম ধাতু নিষ্কাশন করা হয়।
গ. গ ধাতুর অক্সাইড হলো অ্যালুমিনা, Al২O3। এটি অধিক সক্রিয় ধাতুসমূহের অক্সাইড। এ থেকে ধাতু মুক্ত করার জন্য তড়িৎ বিশ্লেষণ পদ্ধতি ব্যবহার করা হয়।
Al২O3 এর গলনাঙ্ক প্রায় ২০৫০0C। এতো উচ্চ তাপমাত্রা অর্জন ব্যয়বহুল। তাই এর সাথে ক্রায়োলাইট নামক খনিজের দ্রবণ মিশিয়ে কাজ করা হয়। উভয়ের মিশ্রণে Al ৯০০-৯৫০0C তাপমাত্রায় গলে যায়। একটি ইস্পাতের ট্যাংকের ভেতরের অংশ গ্রাফাইটের স্তর অর্থাৎ কার্বন দ্বারা আবৃত করা হয়। এ কার্বন স্তর ক্যাথোড হিসেবে কাজ করে। অ্যানোড হিসেবে কার্বন দণ্ড ব্যবহৃত হয়। এ ট্যাংকে গলিত বক্সাইটের মধ্য দিয়ে বিদ্যুৎ প্রবাহিত করা হয়। এ তড়িৎ প্রবাহের কারণে Al২O3 এর তড়িৎ বিশ্লেষণ চলতে থাকে এবং গ ধাতুটি নিষ্কাশিত হয়।
তড়িৎ বিশ্লেষণের মূলনীতি :
MnO2 -→ ২Mn+ + nO2¯ অর্থাৎ Al২O3 -→ ২Al৩+ + ৩O2¯
ঘ. গ ধাতুর অক্সাইড অর্থাৎ Al২O3-এর তড়িৎ বিশ্লেষণ চলাকালে ইস্পাতের ট্যাংকে ক্যাথোডে অ্যালুমিনিয়াম ধাতু অর্থাৎ গ সঞ্চিত হতে থাকে। গ ধাতু ক্রায়োলাইট থেকে ভারী হওয়ায় নিচের দিকে জমতে থাকে।
ট্যাংকের নিচের প্লাগ মাঝে মাঝে খুলে গ ধাতুকে বের করে আনা হয়। অ্যানোডে অক্সিজেন উৎপন্ন হয়, যা কার্বনের সাথে বিক্রিয়া করে CO2 উৎপন্ন করে। তড়িৎ বিশ্লেষণে রাসায়নিক বিক্রিয়াসমূহ হচ্ছে –
ক্যাথোডে : Al৩+ + ৩e− -→ Al (গ)
অ্যানোডে : O2¯ -→ O + ২e−
২O -→ O2(g)
পরবর্তীতে কার্বনের সাথে অক্সিজেনের বিক্রিয়া :
C + O2 -→ CO2
প্রশ্ন -৫ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
ভূত্বকে উপস্থিত গুরুত্বপূর্ণ মৌলসমূহ হলো : ক্যালসিয়াম, অক্সিজেন, সিলিকন, অ্যালুমিনিয়াম, আয়রন, পটাসিয়াম, সোডিয়াম ও ম্যাগনেসিয়াম। এগুলো প্রকৃতিতে খনিজ বা আকরিক রুপে পাওয়া যায় এবং এদের সক্রিয়তা বিভিন্ন রকম।
ক. ভূত্বকের উপাদানগুলোর মধ্যে অধাতু কী কী? ১
খ. অ্যালুমিনিয়াম ও সোডিয়ামের যে যৌগ প্রকৃতিতে পাওয়া যায় তাদের নাম ও সংকেত লেখ। ২
গ. উদ্দীপকের প্রথম মৌলটি প্রকৃতিতে কীভাবে পাওয়া যায়? বর্ণনা কর। ৩
ঘ. উদ্দীপকের ধাতুগুলোকে সক্রিয়তাক্রমের ভিত্তিতে সাজাও এবং সক্রিয়তার ভিন্নতা ব্যাখ্যা কর। ৪
⇔ ৫নং প্রশ্নের উত্তর ⇔
ক. ভূত্বকের উপাদানগুলোর মধ্যে অধাতু হলো অক্সিজেন ও সিলিকন।
খ. অ্যালুমিনিয়ামের যে যৌগ প্রকৃতিতে পাওয়া যায় তা হলো বক্সাইট। এর সংকেত Al২O3.২H2O এবং সাগরের পানির মধ্যে সোডিয়ামের যৌগ পাওয়া যায়। এর সংকেত NaCl।
গ. উদ্দীপকের প্রথম মৌলটি হলো ক্যালসিয়াম যা প্রকৃতিতে কঠিন পাললিক শিলা আকারে পাওয়া যায়।
ক্যালসিয়ামের যৌগ হলো চুনাপাথর বা ক্যালসিয়াম কার্বনেট (CaCO3)। চুনাপাথর (ক্যালসিয়াম কার্বনেট) বৃষ্টির পানিতে ধুয়ে সাগরে যায়। যেখানে তলানি জমে চুনাপাথর ও বেলে পাথর সৃষ্টি হয়। তলানি বিভিন্ন স্তরে জমা হয়। এজন্য শিলাতে বিভিন্ন স্তর দেখা যায়। টিলা বা পর্বত চ‚ড়াতেও বিভিন্ন স্তর দেখা যায়। সিমেন্ট জাতীয় পদার্থ ক্যালসিয়াম কার্বনেট ক্ষুদ্র কণাগুলোকে শক্ত করে ধরে রেখে পাথর বা শিলায় পরিণত করে। এই শিলা পাললিক শিলা। এভাবে ক্যালসিয়ামের শিলা গঠিত হয়।
ঘ. উদ্দীপকের অক্সিজেন ও সিলিকন মৌল দুটি ছাড়া বাকিগুলো ধাতু। এগুলোর সক্রিয়তা ক্রম হলো পটাসিয়াম > ক্যালসিয়াম > সোডিয়াম > ম্যাগনেসিয়াম > অ্যালুমিনিয়াম > আয়রন বা লোহা প্রকৃতিতে উচ্চ সক্রিয় ধাতুসমূহের যৌগ প্রচুর পরিমাণে পাওয়া যায় এবং মধ্যম ও কম সক্রিয় ধাতুর যৌগ খুব কম পাওয়া যায়।
ক উচ্চ সক্রিয় ধাতু আর Fe মধ্যম সক্রিয় ধাতু। তাই ক এর চেয়ে Fe মূল্যবান। নিষ্ক্রিয় ধাতু যেমন স্বর্ণকে (Au) প্রকৃতিতে মুক্ত অবস্থায় পাওয়া গেলেও তা প্রায় বিরল। এজন্য স্বর্ণ অত্যন্ত মূল্যবান।
নবম দশম রসায়ন ১০ম অধ্যায় সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন -৬ : নিচের ছকটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :

ক. ম্যাগমা কী? ১
খ. স্বর্ণ অত্যন্ত মূল্যবান কেন? ২
গ. অ কীভাবে তৈরি হয়? ৩
ঘ. ই ও ঈ শিলার গঠন প্রক্রিয়া বর্ণনা কর। ৪
⇔ ৬নং প্রশ্নের উত্তর ⇔
ক. ভ‚গর্ভের উচ্চ তাপে গলিত শিলাকে ম্যাগমা বলে।
খ. স্বর্ণ বিরল বলে তা মূল্যবান।
স্বর্ণ একটি নিষ্ক্রিয় ধাতু। প্রকৃতিতে মুক্ত অবস্থায় পাওয়া গেলেও তা প্রায় বিরল।
গ. অ হলো ক্ষয়প্রাপ্ত শিলা যা প্রাকৃতিক কারণে তৈরি হয়।
বিভিন্ন খনিজ পদার্থ মিশ্রিত হয়ে শক্ত কণার মিশ্রণ তৈরি হয়। অধিকাংশ শিলা কতগুলো শক্ত কণার মিশ্রণে সৃষ্টি হয়। নানাবিধ প্রাকৃতিক কারণে এই শিলা ক্ষয়প্রাপ্ত হয় অর্থাৎ অ তে পরিণত হয়। যেমন : আবহাওয়ার সাথে সাথে অর্থাৎ তাপমাত্রা, বৃষ্টি, কুয়াশা, ঝড়, বায়ু প্রবাহ ইত্যাদির কারণে শিলা ক্ষয়প্রাপ্ত হয়। এ কারণে চুনাপাথর (ক্যালসিয়াম কার্বনেট) বৃষ্টির পানিতে ধুয়ে সাগরে যায়। সেখানে তলানি জমে চুনাপাথর ও বেলে পাথর সৃষ্টি হয়।
ঘ. এখানে ই হলো আগ্নেয় শিলা এবং ঈ হলো পাললিক শিলা। নিচে এদের গঠন প্রক্রিয়া বর্ণনা করা হলো :
আগ্নেয় শিলার গঠন : ভ‚গর্ভের উচ্চ তাপে শিলা গলে যায়। এই গলিত অবস্থাকে ম্যাগমা বলে। ম্যাগমা ঠাণ্ডা হলে পুনরায় কঠিন শিলায় পরিণত হয়। এই শিলাকে আগ্নেয় শিলা বলে।
পাললিক শিলার গঠন : বিভিন্ন খনিজ পদার্থ মিশ্রিত হয়ে এই কণাগুলো তৈরি হয়েছে। শিলা সবসময় এক রকম থাকে না। আবহাওয়ার সাথে সাথে অর্থাৎ তাপমাত্রা, বৃষ্টি, কুয়াশা, ঝড়, বায়ু প্রবাহ ইত্যাদির কারণে শিলা ক্ষয়প্রাপ্ত হয়। চুনাপাথর (ক্যালসিয়াম কার্বনেট) বৃষ্টির পানিতে ধুয়ে সাগরে যায়। সেখানে তলানি জমে চুনাপাথর ও বেলে পাথর সৃষ্টি হয়। তলানি বিভিন্ন স্তরে জমা হয়। এজন্য শিলাতে বিভিন্ন স্তর দেখা যায়। টিলা বা পর্বত চ‚ড়াতেও বিভিন্ন স্তর দেখা যায়। সিমেন্ট জাতীয় পদার্থ ক্যালসিয়াম কার্বনেট ক্ষুদ্র কণাগুলোকে শক্ত করে ধরে রেখে পাথর বা শিলায় পরিণত করে। এই শিলা হলো পাললিক শিলা।
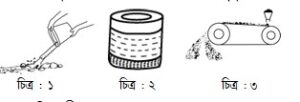
প্রশ্ন -৭ : নিচের চিত্রগুলো পর্যবেক্ষণ কর এবং সংশ্লিষ্ট প্রশ্নগুলোর উত্তর দাও :
ক. আকরিক কী? ১
খ. লোহা অপেক্ষা স্টিলের ব্যবহার উপযোগিতা বেশি কেন? ২
গ. উদ্দীপকের পদ্ধতিগুলোর কার্যকারিতা ব্যাখ্যা কর। ৩
ঘ. ২নং চিত্রের পদ্ধতিটি কোন ক্ষেত্রে ব্যবহার করা হয় বিশ্লেষণ কর। ৪
⇔ ৭নং প্রশ্নের উত্তর ⇔
ক. যে সকল খনিজ থেকে লাভজনকভাবে ধাতু নিষ্কাশন করা যায় তাকে আকরিক বলে।
খ. লোহা হলো ধাতু আর স্টিল হলো লোহার ধাতু সংকর। ধাতব লোহার ৯৯% এবং অধাতু ১% গলিত অবস্থায় মিশ্রিত করে স্টিল তৈরি করা হয়। স্টিল লোহা অপেক্ষা বেশি নমনীয় ঘাতসহ এবং ক্ষয় কম হয়। তাই লোহা অপেক্ষা স্টিলের ব্যবহার উপযোগিতা বেশি।
গ. উদ্দীপকের চিত্র-১ এর পদ্ধতি হলো ধাতু নিষ্কাশনের সময় আকরিকের মধ্যে যান্ত্রিক উপায়ে পানি প্রবাহিত করা। এতে অভিকর্ষ বলের সহায়তায় ধাতুর আকরিকের হালকা খনিজমলগুলো পৃথকীকরণ করা হয়।
উদ্দীপকের চিত্র-২ এর পদ্ধতিগুলো তেল ফেনা ভাসমান পদ্ধতি। এতে সালফাইড আকরিকসমূহ তেলসিক্ত হয়ে পানির উপরে ফেনার মতো ভেসে ওঠে। ফেনাসহ আকরিক পৃথক করে নেওয়া হয়। খনিজমল পাত্রের তলায় পড়ে থাকে।
উদ্দীপকের চিত্র-৩ এর পদ্ধতি হলো চৌম্বকীয় পৃথকীকরণ, আকরিক বা খনিজমলের কোনো একটির যদি চৌম্বক ধর্ম থাকে তাহলে এই পদ্ধতি ব্যবহার করা হয়।
ঘ. ২নং চিত্রের পদ্ধতি সাধারণত সালফাইড আকরিক ঘনীকরণে ব্যবহৃত হয়।
সালফাইড আকরিক সহজে তেল সিক্ত হয়। বিচ‚র্ণিত আকরিক একটি বড় গামলায় নিয়ে এতে পানি যোগ করে অল্প পরিমাণে উপযুক্ত তেল মিশানো হয়। অতঃপর পানিতে বায়ুপ্রবাহের সাহায্যে আলোড়ন সৃষ্টি করা হয়।
সাধারণত চালকোসাইট (Cu2S), জিংক বেøন্ড (ZnS), গ্যালেনা (PbS), সিন্নাবার (HgS), কপার পাইরাইট (CuFeS2) ইত্যাদি আকরিক ঘনীকরণে এই পদ্ধতি ব্যবহৃত হয়। এতে আকরিক থেকে খনিজমল দূর হয়।
প্রশ্ন -৮ : নিচের ছকটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
![]()
ক. মানুষ সর্বপ্রথম কোন ধাতু নিষ্কাশন করেছিল? ১
খ. আকরিক বিচ‚র্ণকে জো ক্রাশারে ও বল ক্রাশারে কী করা হয়? ২
গ. ধাতু নিষ্কাশনে অ ধাপটি ব্যাখ্যা কর। ৩
ঘ. উদ্দীপকের ই ধাপটির গুরুত্ব মূল্যায়ন কর। ৪
⇔ ৮নং প্রশ্নের উত্তর ⇔
ক. মানুষ সর্বপ্রথম কপার ধাতু নিষ্কাশন করেছিল।
খ. প্রকৃতিতে অধিকাংশ আকরিক বিশাল বিশাল শিলা খণ্ড হিসেবে পাওয়া যায়। এই বিশাল শিলাখণ্ডকে ভেঙে ক্ষুদ্র ক্ষুদ্র কণায় রূপান্তর করা হয়। এজন্য আকরিককে প্রথমে জো ক্রাশারে ছোট ছোট টুকরা করা হয় এবং পরে বল ক্রাশারে পাউডারে পরিণত করা হয়।
গ. ধাতু নিষ্কাশনে অ ধাপটি হলো ঘনীকৃত আকরিককে অক্সাইডে রূপান্তর। ভস্মীকরণ ও তাপজারণ দ্বারা এ রূপান্তর সম্পন্ন করা হয়।
ভস্মীকরণ : ঘনীকৃত আকরিককে গলনাঙ্কের চেয়ে কম তাপমাত্রায় বায়ুর অনুপস্থিতিতে উত্তপ্ত করা হয়। এর ফলে আকরিক থেকে জৈব উপাদান ও জলীয়বাষ্প দূরীভ‚ত হয়। এ প্রক্রিয়ায় ধাতুর আর্দ্র অক্সাইড বা কার্বনেট, ধাতব অক্সাইডে পরিণত হয়।
CaCO3 (চুনাপাথর) –→ Cao + CO2
Al২O3. ২H2O (বক্সাইট) –→ Al২O3 + ২H2O
২Fe২O3 .৩H2O (হেমাটাইট) –→২Fe২O3 + ৩H2O
তাপজারণ : সাধারণত সালফাইড আকরিকের তাপজারণ করা হয়। সালফাইড আকরিককে বায়ু প্রবাহের উপস্থিতিতে গলনাঙ্ক তাপমাত্রার নিম্ন তাপমাত্রায় উত্তপ্ত করা হয়। খনিজমল যেমন, সালফার, আর্সেনিক, ফসফরাস ইত্যাদি উদ্বায়ী অক্সাইডরূপে দূরীভ‚ত হয়।
২ZnS (জিংক বেøন্ড) + ৩O2 –→ ২ZnS + ২SO2
২PbS (গ্যালে না) + ৩O2 –→ ২PbO + ২SO2
ঘ. ধাতুর আকরিকের ই ধাপটি হলো বিশোধন যার গুরুত্ব অপরিসীম। তড়িৎ বিশ্লেষণে শেষ পর্যন্ত ধাতুর আকরিকে কিছু খনিজমল থেকে যায়। এই খনিজমল দূর করার জন্য আকরিকের সাথে ফ্লাক্স বা বিগালক যোগ করা হয়। উচ্চ তাপমাত্রায় আকরিকের ধাতব অক্সাইড বিজারিত হয়ে ধাতু মুক্ত হয় এবং ফ্লাক্স খনিজমলের সাথে যুক্ত হয়ে ধাতুমল উৎপন্ন করে। ধাতুমল গলিত ধাতুতে দ্রবীভ‚ত হয় না। অপেক্ষাকৃত হালকা বলে ধাতুমল সহজেই গলিত ধাতু থেকে পৃথক করা যায়। এ প্রক্রিয়াকে বিগলন বলে।
খনিজমলগুলো এসিড বা ক্ষার ধর্ম বিশিষ্ট হয়। এসিড ধর্ম বিশিষ্ট খনিজমল দূর করার জন্য ক্ষার ধর্ম বিশিষ্ট ফ্লাক্স এবং ক্ষার ধর্মবিশিষ্ট খনিজমল দূর করার জন্য এসিড ধর্ম বিশিষ্ট ফ্লাক্স যোগ করা হয়। যেমন :
Cao + SiO2 –→ CaSiO3
ক্ষারকীয় ফ্লাক্স এসিডিক খনিজমল ক্যালসিয়াম সিলিকেট
Mnঙ + SiO2 –→ MnSiO3
ক্ষারকীয় খনিজমল এসিডিক ফ্লাক্স ম্যাঙ্গানিজ সিলিকেট
FeO(s) + SiO2 –→ FeSiO3
ক্ষারকীয় খনিজমল এসিডিক ফ্লাক্স ফেরাস সিলিকেট
বিগলন প্রক্রিয়ায় প্রাপ্ত ধাতুকে আরো বিশুদ্ধ করার জন্য তড়িৎ বিশোধন করা হয়। যেমন : বিগলন প্রক্রিয়ায় উৎপন্ন কপার বা তামা ৯৮% বিশুদ্ধ হয়। একে তড়িৎবিশ্লেষণ করলে ৯৯.৯% বিশুদ্ধ কপার বা তামা পাওয়া যায়। তড়িৎ বিশ্লেষণে শক্তি ব্যবহার করে রাসায়নিক বিক্রিয়া সংগঠন করা হয়।
অতএব, উদ্দীপকের ই ধাপটির গুরুত্ব অনস্বীকার্য।
SSC Chemistry chapter 10 srijonshil
প্রশ্ন -৯ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
ঢ একটি যৌগ, যার গলনাঙ্ক ৮০১0C। এটি সমুদ্রের পানি শুকিয়ে পাওয়া যায়। ণ একটি যৌগ যা ঢ থেকে সোডিয়াম নিষ্কাশন গলনাঙ্ক কমানোর জন্য ব্যবহার করা হয়। ৪০-৪২% ঢ ও ৫৮ – ৬০% ণ এর গলনাঙ্ক প্রায় ৬০০0C।
ক. ক্যালামাইনের সংকেত কী? ১
খ. কপার এর নিষ্কাশনে স্ববিজারণ বলতে কী বোঝ? ২
গ. উদ্দীপকে উল্লিখিত পদ্ধতিতে সোডিয়াম নিষ্কাশনের প্রক্রিয়া বর্ণনা কর। ৩
ঘ. উদ্দীপকে উল্লিখিত পদ্ধতিতে সোডিয়ামের সাথে ক্যালসিয়াম ধাতু মুক্ত হবে কিনা তা ব্যাখ্যা কর। ৪
⇔ ৯নং প্রশ্নের উত্তর ⇔
ক. ক্যালামাইনের সংকেত হলো ZnCO3।
খ. কপারের নিষ্কাশনে চালকোসাইট (Cu2S) অক্সিজেনের সাথে বিক্রিয়া করে Cu2O উৎপন্ন করে।
Cu2S + O2 -→ Cu2O + SO2
উৎপন্ন Cu2O আবার Cu2S এর সাথে বিক্রিয়া করে কপার ধাতু যুক্ত করে। একে Cu এর স্ববিজারণ বলা হয়।
Cu2S + Cu2O -→ Cu + SO2
গ. উদ্দীপকে উল্লিখিত পদ্ধতিটি হচ্ছে ডাউনের পদ্ধতি। ডাউনের পদ্ধতিতে NaCl এর সাথে CaCl২ মিশ্রিত করে সোডিয়াম ধাতু নিষ্কাশন করা হয়। সুতরাং, উদ্দীপকে ঢ যৌগটি হচ্ছে NaCl এবং ণ যৌগটি হচ্ছে CaCl২। এ প্রণালিতে বিগলিত সোডিয়াম ক্লোরাইডকে তড়িৎ বিশ্লেষণ করা হয়। ফলে ক্যাথোডে সোডিয়াম ধাতু বিমুক্ত হয়।
NaCl (বিগলিত) → Na+ + Cl¯
Na+ + ব¯ = Na (ক্যাথোড)
২Cl¯ + ২ব¯ (অ্যানোড)
NaCl এর গলনাঙ্ক ৮০১0C। এত উচ্চ তাপমাত্রায় উৎপন্ন সোডিয়াম ধাতু বাষ্পীভ‚ত হয়ে অপচয় হয়। বাষ্পীভ‚ত সোডিয়াম ও সোডিয়াম ক্লোরাইড বিদ্যুৎ কোষে একটি ধাতব কুয়াশা সৃষ্টি করে অসুবিধা ঘটায় এবং সর্বোপরি উচ্চ তাপ প্রয়োগ বেশ ব্যয় সাপেক্ষ। তাই এ প্রক্রিয়ায় সোডিয়াম ক্লোরাইডের সঙ্গে ক্যালসিয়াম ক্লোরাইড মিশিয়ে বিগলিত করা হয়। ফলে সোডিয়াম ক্লোরাইডের গলনাঙ্ক ৬০০0C এ হ্রাস পায়।
ঘ. উদ্দীপকে উল্লিখিত পদ্ধতিতে ক্যালসিয়াম ধাতু মুক্ত হবে না।
উদ্দীপকে উল্লিখিত পদ্ধতিটি হচ্ছে একটি তড়িৎ রাসায়নিক প্রক্রিয়া এবং সোডিয়াম ধাতু নিষ্কাশন করা হচ্ছে একটি তড়িৎ রাসায়নিক কোষের মাধ্যমে। ‘গ’ থেকে জানা যায় তড়িৎ রাসায়নিক কোষের দ্রবণে ক্যাটায়নগুলো হচ্ছে Na+ ও Ca+। তড়িৎ রাসায়নিক সারণি থেকে দ্রবণে Ca২+ আয়নের আয়নিক অবস্থায় থাকার প্রবণতা Na+ আয়ন থেকে বেশি।
সুতরাং, তড়িৎ বিশ্লেষণ বিক্রিয়ায় Ca২+ অংশগ্রহণ করে না, অর্থাৎ ডাউনের পদ্ধতিতে ক্যাথোডে সংঘটিত বিক্রিয়ার ক্ষেত্রে শুধুমাত্র Na+ বিজারিত হয়ে Na ধাতু হিসেবে মুক্ত হচ্ছে। এক্ষেত্রে কোনো Ca ধাতু মুক্ত হয় না।
প্রশ্ন -১০ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
চালকোসাইটকে অক্সিজেনের সাথে বিক্রিয়ার মাধ্যমে একটি ধাতু মুক্ত করা হয়। এই পদ্ধতিতে উক্ত ধাতুর স্ববিজারণ সংঘটিত হয়। এতে একটি বিষাক্ত গ্যাস পরিবেশে নিষ্কাশিত হয়।
ক. মরিচাবিহীন ইস্পাতের সংযুক্তি লেখ। ১
খ. কার্বন বিজারণ বলতে কী বোঝ? ২
গ. উদ্দীপকে উল্লিখিত প্রক্রিয়াটির বিক্রিয়াসহ লেখ। ৩
ঘ. উৎপন্ন বিষাক্ত গ্যাসকে কি কোনোভাবে লাভজনক কাজে ব্যবহার করা সম্ভব? তোমার মতামতের সপক্ষে যুক্তি প্রদর্শন কর। ৪
⇔ ১০নং প্রশ্নের উত্তর ⇔
ক. মরিচাবিহীন ইস্পাতের সংযুক্তি হলো লোহা ৭৪%, ক্রোমিয়াম ১৮%, নিকেল ৮%।
খ. অনেক ধাতুর আকরিক ধাতব অক্সাইড এবং এই ধাতব অক্সাইডকে কার্বনসহ তাপ দিলে ধাতু মুক্ত হয়। এ প্রক্রিয়াকে কার্বন বিজারণ বলা হয়।
এই প্রক্রিয়াতে কার্বন অক্সিজেনের সাথে বিক্রিয়া করে কার্বন মনো ও ডাইঅক্সাইড উৎপন্ন করে।
M2ঙহ + হঈ -→ ২গ + হCO
M2ঙহ + হCO -→ ২গ + হCO2
এখানে, গ হচ্ছে মধ্যম সক্রিয় ধাতুসমূহ।
গ. উদ্দীপকে উল্লিখিত চালকোসাইট (Cu2S) হচ্ছে কপারের (Cu) আকরিক। একে অক্সিজেনের সাথে দহনের মাধ্যমে কপার (Cu) ধাতুমুক্ত করা হয়। Cu2S(s) (চালকোসাইট) + O2(g) -→ ২Cu + SO2 বিক্রিয়াটি একাধিক ধাপে সম্পন্ন হয়। যেমন –
Cu2S(s) (চালকোসাইট) + O2(g)-→২Cu2O + SO2
জারণ বিক্রিয়ায় উৎপন্ন কিউপ্রাস অক্সাইড অজারিত কিউপ্রাস সালফাইডের সাথে বিক্রিয়া করে কপার ধাতু মুক্ত করে। এই প্রক্রিয়াকে স্ববিজারণ বলা হয়।
২Cu2S + ২Cu2O -→ ৬Cu + SO2
ঘ. উৎপন্ন বিষাক্ত গ্যাসকে লাভজনক কাজে ব্যবহার করা সম্ভব।
চালকোসাইটের সাথে অক্সিজেনের বিক্রিয়ায় উৎপন্ন বিষাক্ত গ্যাস হচ্ছে সালফার ডাইঅক্সাইড (SO2)। উৎপন্ন সালফার ডাইঅক্সাইড পরিবেশের জন্য অত্যন্ত ক্ষতিকর। এটি এসিড বৃষ্টির জন্য দায়ী।
তবে এটাকে সংগ্রহ করে লাভজনক কাজে ব্যবহার করা সম্ভব।
সালফিউরিক এসিড উৎপাদনে একটি গুরুত্বপূর্ণ মধ্যবর্তী উৎপাদ হচ্ছে SO2। SO2 আবার অক্সিজেনের (O2) সাথে বিক্রিয়া করে SO3 উৎপন্ন করে। উৎপন্ন SO3 আবার H2SO4 এর সাথে বিক্রিয়া করে H2S2ঙ৭ উৎপন্ন করে। পরে H2S2ঙ৭ পানির (H2O) সাথে বিক্রিয়া করে সালফিউরিক এসিড (H2SO4) উৎপন্ন করে। বিক্রিয়াসমূহ হচ্ছে-
SO2 + O2 -→ SO3
SO3 + H2SO4 -→ H2S2ঙ৭
H2S2ঙ৭ + H2O -→ ২H2SO4
প্রশ্ন -১১ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
ক. কাসার সংযুক্তি লেখ। ১
খ. তাম্রমল বলতে কী বোঝ? ২
গ. উদ্দীপকে উল্লিখিত ছকটি পূর্ণ কর। ৩
ঘ. উদ্দীপকে উল্লিখিত ধাতুসমূহের মাঝে কোনগুলো কার্বন দ্বারা নিষ্কাশন করা সম্ভব? যুক্তিসহ নির্ণয় কর। ৪
⇔ ১১নং প্রশ্নের উত্তর ⇔
ক. কাসাতে কপার হচ্ছে ৯০% এবং টিন ১০%।
খ. তাম্রমল সাধারণত কপার (ওও) কার্বনেট এবং কপার (ওও) হাইড্রক্সাইডের মিশ্রণ [CuCO3.Cu(OH)২]
তামা ও পিতলের তৈরি পাত্র পরিষ্কার না করা হলে এগুলোর গায়ে সবুজ বর্ণের আবরণ সৃষ্টি হয়। একে তাম্রমল বলে। এটি এক প্রকার কপার লবণ। এর উপাদান মূলত পরিবেশের ওপর নির্ভর করে। এটি জৈব এসিডে দ্রবীভ‚ত হয়।
গ. উদ্দীপকে উল্লিখিত ছকটি পূর্ণ করা হলো :
| ধাতু | আকরিক | নিষ্কাশনের বিক্রিয়া |
| Zn | ZnS | O2 →ZnO + SO2
ZnO + C → Zn + CO |
| Pb | PbS | O2→ PbO + SO2
PbO + C→ Pb + CO |
| Fe | Fe2O3 | Fe2O3 + C →Fe + CO2 |
| Cu | Cu2S | Cu2S + O2 → Cu + SO2 |
| Al | Al2O3. 2H2O | Al2O3. 2H2O→ Al2O3+ 2H2O
Al2O3 Al |
ঘ. উদ্দীপকে উল্লিখিত ধাতুসমূহের মাঝে Zn, Pb ও Fe কার্বন দ্বারা নিষ্কাশন করা সম্ভব।
কার্বন একটি মধ্যম শক্তিশালী বিজারক। সক্রিয়তা ক্রমে যে সকল মৌল কার্বনের নিচে অবস্থান করে তাদেরকে কার্বন দ্বারা বিজারণ করা সম্ভব।
ধাতুসমূহের সক্রিয়তার ক্রম হচ্ছে-
Li > ক > Ca > Na > Mg > Al > Mn > Zn > Cr > Fe > Pb > Cu > Ag > Hg > Pt > Au
উল্লিখিত ক্রমে Al এর পরের সকল ধাতুর সক্রিয়তাই কার্বন অপেক্ষা কম। সুতরাং, Al এর নিচে অবস্থানরত সকল মৌলকেই কার্বন বিজারণ পদ্ধতিতে নিষ্কাশন করা সম্ভব।
তবে কপার (Cu) থেকে শুরু করে গোল্ড (Au) পর্যন্ত ধাতু অত্যন্ত নিষ্ক্রিয় বিধায় এগুলো প্রকৃতিতে মুক্ত অবস্থায় অথবা এদের সালফাইড বা কার্বনেট আকরিকের তাপজারণ দ্বারা নিষ্কাশন করা হয়।
সুতরাং, এদের ভেতর Al কে কার্বন বিজারণ পদ্ধতিতে নিষ্কাশন করা সম্ভব নয়।
Zn, Pb ও Fe শুধুমাত্র কার্বন বিজারণ পদ্ধতিতে নিষ্কাশন করা যায়। বাকি Cu-কে আকরিকের তাপজারণ দ্বারা মুক্ত করা হয়।
নবম দশম রসায়ন ১০ম অধ্যায় সৃজনশীল প্রশ্নব্যাংক
প্রশ্ন-৩৮ : সক্রিয়তা ক্রম অনুসারে ধাতুসমূহের অবস্থান দেখানো হলো :
Mg
Al
Zn
Fe
Pb
ক. সোডিয়াম ধাতুর নিষ্কাশন কোন পদ্ধতিতে করা হয়? ১
খ. CO একটি বিজারক কেন? ২
গ. ২য় ধাতুটির নিষ্কাশন পদ্ধতি আলোPbা কর। ৩
ঘ. ৪র্থ ধাতুটির নিষ্কাশনে বাত্যাচুল্লিতে গরম বাতাস প্রবাহের কারণ ব্যাখ্যা কর। ৪
প্রশ্ন-৩৯ :

ক. অ্যানোড কী? ১
খ. তড়িৎ বিশ্লেষণের মাধ্যমে Cu বিশুদ্ধকরণে অ্যানোড ক্ষয়প্রাপ্ত হয় কেন? ২
গ. চিত্রের প্রক্রিয়ায় অবিশুদ্ধ কপারকে কীভাবে বিশুদ্ধ করবে বর্ণনা কর। ৩
ঘ. দ্রবণে যদি অ্যানোড Zn নেওয়া হয় তবে সেক্ষেত্রে কী ঘটবে বর্ণনা কর। ৪
প্রশ্ন-৪০ : শিলাস্তরে ও ভূত্বকে বক্সাইট পাওয়া যায়। চূর্ণ-বিচূর্ণ বক্সাইটকে উচ্চ তাপমাত্রায় NaOH সহ উত্তপ্ত করলে বক্সাইট তরলে পরিণত হয়। এর সাথে যে অপদ্রব্যগুলো থাকে তার কোনো পরিবর্তন হয় না। আকরিক থেকে সংশ্লিষ্ট ধাতু নিষ্কাশনে কার্বন বিজারণ নয় তড়িৎ বিশ্লেষণ উপযুক্ত পন্থা।
ক. বক্সাইটের সংকেত লেখ। ১
খ. বক্সাইট গলাতে ক্ষার ব্যবহার করা হয় কেন? ২
গ. উদ্দীপকে উল্লিখিত আকরিক হতে অ্যালুমিনা পেতে প্রয়োজনীয় বিক্রিয়াসমূহ লেখ। ৩
ঘ. উদ্দীপকে শেষোক্ত উক্তিটির যথার্থতা বিশ্লেষণ কর। ৪
প্রশ্ন-৪১ : সকল রাসায়নিক দ্রব্যের মধ্যে সালফিউরিক এসিড সবচেয়ে বেশি পরিমাণে উৎপন্ন ও ব্যবহার করা হয়। স্পর্শ পদ্ধতিতে H2SO4 এর শিল্পোৎপাদন করা হয়। এক্ষেত্রে রাসায়নিক বিক্রিয়াসমূহ হচ্ছে-
২SO2(g) + O2(g) ২SO3(g) ……. (র)
SO3(g) + H2O(ষ) → H2SO4 (ষ) ……………………..(রর)
ক. স্পর্শ পদ্ধতিতে সালফিউরিক এসিড উৎপাদনের উপযুক্ত তাপমাত্রা কত? ১
খ. চিনির মধ্যে H2SO4 ঢাললে তা কালো হয়ে যায় কেন? ২
গ. উপরিউক্ত পদ্ধতিতে সর্বোচ্চ পরিমাণ H2SO4 উৎপাদনের শর্তসমূহ লেখ। ৩
ঘ. (রর) নং বিক্রিয়ার সাহায্যে H2SO4 প্রস্তুত না করে SO3 কে ৯৮% H2SO4 এ শোষণ করানো হয় কেন? ব্যাখ্যা কর। ৪
প্রশ্ন-৪২ দশম শ্রেণির রসায়ন শিক্ষক ইমরান সাহেব তার ছাত্র-ছাত্রীদের ব্রোঞ্জ যুগের কথা বলছিলেন। তিনি আরও বললেন, ধাতুর পুনঃপ্রক্রিয়াজাতকরণের মাধ্যমে পরিবেশগত সমস্যার সমাধান সম্ভব।
ক. তাম্র যুগ কী? ১
খ. তাম্রমল কীভাবে দূরীভ‚ত হয়? ২
গ. ইমরান সাহেব যে যুগের কথা বলছিলেন, তার বর্ণনা দাও। ৩
ঘ. উদ্দীপকের শিক্ষকের শেষোক্ত উক্তিটির যথার্থতা বিশ্লেষণ কর। ৪
প্রশ্ন-৪৩ নিচের ছকটি পর্যবেক্ষণ কর এবং সংশ্লিষ্ট প্রশ্নগুলোর উত্তর দাও :
যৌগ গলনাঙ্ক মিশ্রণের সংযুতি %
চ ৮০১0C ৪০-৪২%
ছ – ৫৮-৬০%
ক. তাম্রমলের রাসায়নিক সংকেত কী? ১
খ. জিংকের দুটি আকরিকের নাম ও সংকেত লেখ। ২
গ. উদ্দীপকের চ যৌগটির নিষ্কাশন প্রক্রিয়া বর্ণনা কর। ৩
ঘ. তড়িৎ রাসায়নিক প্রক্রিয়ায় ধাতু নিষ্কাশনে চ ও ছ উভয় যৌগের ধাতু নিষ্কাশন সম্ভব কিনা- বিশ্লেষণ কর। ৪
প্রশ্ন-৪৪ নিচের ছকটি পর্যবেক্ষণ কর এবং সংশ্লিষ্ট প্রশ্নগুলোর উত্তর দাও :
মৌল পর্যায় সারণিতে অবস্থান
ঢ চতুর্থ পর্যায়ের ১১নং গ্রæপ
ণ চতুর্থ পর্যায়ের ১২নং গ্রæপ
ক. হেমাটাইটের রাসায়নিক নাম কী? ১
খ. স্e- বিজারণ বলতে কী বোঝায়? ২
গ. উদ্দীপকের ঢ ধাতুটির তড়িৎ বিশোধন ব্যাখ্যা কর। ৩
ঘ. উদ্দীপকের ণ ধাতুটিকে কার্বন বিজারণ পদ্ধতিতে নিষ্কাশন করা সম্ভব কিনা?-তোমার উত্তরের সপক্ষে যুক্তি দাও। ৪
প্রশ্ন-৪৫ নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
চ হলো পর্যায় সারণির ১৬নং গ্রুপে অবস্থিত ‘১৬’ পারমাণবিক সংখ্যাবিশিষ্ট একটি মৌল। অ-এর দুইটি অক্সাইড হলো যথাক্রমে চO2 এবং চO3।
ক. ধাতু প্রক্রিয়াজাতকরণ কী? ১
খ. অত্যানুক‚ল তাপমাত্রা বলতে কী বোঝ? ২
গ. খনি থেকে উদ্দীপকের চ মৌলটির নিষ্কাশন পদ্ধতি বর্ণনা কর। ৩
ঘ. উদ্দীপকের অক্সাইডগুলোর মধ্যে কোনটি রঙিন বস্তুকে বর্ণহীন করলেও অন্যটি তা পারে না কেন? -বিশ্লেষণ কর। ৪
প্রশ্ন -৪৬ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :

ক. রেকটিফাইড স্পিরিট কাকে বলে? ১
খ. পলিমারকরণ বিক্রিয়া ব্যাখ্যা কর। ২
গ. উদ্দীপকে উল্লিখিত ধাতুর চৌম্বকীয় অক্সাইডটির শতকরা সংযুক্তি নির্ণয় কর। ৩
ঘ. ধাতুটি নিষ্কাশনে চুল্লিতে যে বিক্রিয়াগুলো ঘটে তা বিশ্লেষণ কর। ৪
প্রশ্ন -৪৭ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
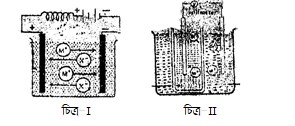
ক. মোলার দ্রবণ কাকে বলে? ১
খ. বিøচিং পাউডারের দাগ উঠানোর কৌশল ব্যাখ্যা কর। ২
গ. ও নং কোষের সাহায্যে কপারের তড়িৎ বিশোধন কীভাবে করা হয়- ব্যাখ্যা কর। ৩
ঘ. ওও নং কোষের সাহায্যে বিদ্যুৎ উৎপাদনের সম্ভাব্যতা বিশ্লেষণ কর। ৪
প্রশ্ন -৪৮ : নিচের চিত্রের আলোকে প্রশ্নগুলোর উত্তর দাও :

ক. নিউক্লিয়ার ফিসন কী? ১
খ. অ্যামোনিয়া ক্ষারধর্মী কেন? ব্যাখ্যা কর। ২
গ. ঈ যৌগটির কেন্দ্রীয় পরমাণুর জারণ সংখ্যা নির্ণয় কর। ৩
ঘ. অ → ই → ঈ এবং অ → ঈ এই দুটি পথের মধ্যে ঈ উৎপাদনের জন্য কোন পথটি উত্তম? সমীকরণসহ বর্ণনা কর। ৪
প্রশ্ন-৪৯ A2(g) + ২B2(g) ২AB2(g); বিক্রিয়াটিতে অ – অ, ই – ই এবং অ – ই বন্ধনশক্তি যথাক্রমে ৪৯৮ শঔ/সড়ষব এবং ৪৬৪ শঔ/সড়ষব।
ক. জারণ কাকে বলে? ১
খ. ইথানল ও ডাইমিথাইল ইথার পরস্পরের সমাণু- ব্যাখ্যা কর। ২
গ. উদ্দীপকের বিক্রিয়ার তাপের পরিবর্তন (ΔH) নির্ণয় কর। ৩
ঘ. কোন শর্তে সর্বোচ্চ পরিমাণ AB2 যৌগ উৎপাদন করা যাবে? লাশাতেলিয়ের নীতির আলোকে বিশ্লেষণ কর। ৪