নবম-দশম/এসএসসি রসায়ন তৃতীয় অধ্যায় পদার্থের গঠন এর পাঠ সম্পর্কিত গুরুত্বপূর্ণ বিষয়াদি,জ্ঞানমূলক প্রশ্ন ও উত্তর ও অনুধাবনমূলক প্রশ্ন ও উত্তর নিচে দেওয়া হলো।
এসএসসি রসায়ন তৃতীয় অধ্যায় পদার্থের গঠন
পাঠ সম্পর্কিত গুরুত্বপূর্ণ বিষয়াদি
য পদার্থকে বিশ্লেষণ করলে ঐ পদার্থ থেকে মূল পদার্থ ছাড়া পৃথক ধর্মবিশিষ্ট অন্য কোনো নতুন পদার্থ পাওয়া যায় না, তাকে মৌল বা মৌলিক পদার্থ বলে। নাইট্রোজেন, ফসফরাস, কার্বন, অক্সিজেন, হিলিয়াম, ক্যালসিয়াম, আর্গন, ম্যাগনেসিয়াম, সালফার প্রভৃতি মৌলিক পদার্থ।
→ প্রতীক : কোনো মৌলের নাম যা দ্বারা সংক্ষেপে প্রকাশ করা হয়, তাকে প্রতীক বলে। যেমন : ব্রোমিন (Bromine) এর প্রতীক Br বোরন (Boron) এর প্রতীক B ইত্যাদি।
→ মৌলিক কণিকা : যেসব সুক্ষ কণিকা দ্বারা পরমাণু গঠিত, তাদেরকে মৌলিক কণিকা বলা হয়। এরা হচ্ছে ইলেকট্রন, প্রোটন ও নিউট্রন। এ তিনটি কণিকা বিভিন্ন সংখ্যায় একত্রিত হয়ে ভিন্ন ভিন্ন পরমাণু সৃষ্টি করে।
→ ইলেকট্রন : সব পদার্থের পরমাণুর সাধারণ উপাদান হলো ইলেকট্রন। ইলেকট্রন পরমাণুর সবচেয়ে হালকা কণিকা। ইলেকট্রনসমূহ নিজস্ব শক্তি অনুযায়ী নিউক্লিয়াসের বাইরে চারদিকে বিভিন্ন কক্ষপথে ঘূর্ণায়মানভাবে অবস্থান করে। এটি ঋণাত্মক আধানযুক্ত এবং এর আপেক্ষিক আধানকে -১ ধরা হয়। ইলেকট্রনকে ব দ্বারা প্রকাশ করা হয়। একটি ইলেকট্রনের ভর 9.11 × 10-28 গ্রাম; আধান বা চার্জ -1.60 ×10-19 কুলম্ব; একটি ইলেকট্রনের ভর একটি প্রোটন বা একটি নিউট্রনের ভরের ১/১৮৪০ গুণ।
→ প্রোটন : পরমাণুর আর একটি মূল উপাদান প্রোটন। প্রোটনের ভর ইলেকট্রনের চেয়ে প্রায় ১৮৪০ গুণ বেশি। প্রোটন পরমাণুর কেন্দ্র বা নিউক্লিয়াসে অবস্থান করে। এটি ধনাত্মক আধানযুক্ত এবং এর আপেক্ষিক আধানকে +১ ধরা হয়। প্রোটনকে p চিহ্ন দ্বারা প্রকাশ করা হয়। একটি প্রোটনের ভর 1.67 ×10-24 গ্রাম; আধান বা চার্জ +1.60 ×10-19 কুলম্ব;
→ নিউট্রন : নিউট্রন পরমাণুর কেন্দ্র বা নিউক্লিয়াসে থাকে। প্রোটন ও নিউট্রনের আপেক্ষিক ভর সমান। এটি চার্জ নিরপেক্ষ এবং আপেক্ষিক ভর ১ ধরা হয়। নিউট্রনকে n চিহ্ন দ্বারা প্রকাশ করা হয়। নিউট্রনের ভর 1.675 ×10-24 গ্রাম। একই মৌলের বিভিন্ন পরমাণুর মধ্যে নিউট্রনের সংখ্যার বিভিন্নতার কারণে আইসোটোপ সৃষ্টি হয়।
→ পারমাণবিক সংখ্যা : কোনো মৌলের পরমাণুর নিউক্লিয়াস বা কেন্দ্রে যতসংখ্যক প্রোটন থাকে, সেই সংখ্যাকে ঐ মৌলের পারমাণবিক সংখ্যা বলে। এটি একটি পরমাণুর নিজস্ব সত্তা বা তার পরিচয়। সাধারণত মৌলের প্রতীকের বামপাশে নিচের দিকে প্রোটন সংখ্যা তথা পারমাণবিক সংখ্যা লেখা হয়। একে Z দ্বারা প্রকাশ করা হয়। হিলিয়ামে ২টি প্রোটন আছে। সুতরাং এর পারমাণবিক সংখ্যা ২। তাই হিলিয়ামকে 2He লিখে প্রকাশ করা হয়।
→ ভর সংখ্যা : পরমাণুর নিউক্লিয়ন সংখ্যাই তার ভর সংখ্যা। কোনো মৌলের একটি পরমাণুর নিউক্লিয়াসের মধ্যে প্রোটন এবং নিউট্রনের মোট সংখ্যাকে ঐ মৌল বা পরমাণুর ভর সংখ্যা বলে। অর্থাৎ ভর সংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা। একে অ দ্বারা প্রকাশ করা হয়। এটিকে মৌলের প্রতীকের বামপাশে ওপর দিকে লিখা হয়। যেমন, ইউরেনিয়ামের ভর সংখ্যা ২৩৮। সুতরাং, একে 238U লিখে প্রকাশ করা হয়।
→ আইসোটোপ : একই মৌলের বিভিন্ন পরমাণু যাদের পারমাণবিক সংখ্যা বা প্রোটন সংখ্যা একই, কিন্তু ভর সংখ্যা বিভিন্ন হয়, তাদের আইসোটোপ বলে। নিউট্রন সংখ্যার ভিন্নতার কারণে এমন হয়। যেমন : প্রকৃতিতে হাইড্রোজেনের তিনটি আইসোটোপ আছে। এদের নাম হাইড্রোজেন, ডিউটেরিয়াম ও ট্রিটিয়াম। এদের ভর সংখ্যা যথাক্রমে ১, ২ ও ৩। এদের প্রত্যেকের নিউক্লিয়াসে ১টি করে প্রোটন বর্তমান অর্থাৎ প্রত্যেকের পারমাণবিক সংখ্যা ১। কিন্তু, এদের নিউক্লিয়াসে নিউট্রনের সংখ্যা প্রথমটিতে নেই, দ্বিতীয়টিতে ১ এবং তৃতীয়টিতে ২। এজন্য তিন রকম হাইড্রোজেন পরমাণু পাওয়া যায়।
→ আপেক্ষিক পারমাণবিক ভর : কোনো মৌলের আইসোটোপগুলোর শতকরা পর্যাপ্ততার পরিমাণকে গড় করলে যে ভর পাওয়া যায় তাকে ঐ মৌলের আপেক্ষিক পারমাণবিক ভর বলে। সাধারণ অবস্থায় মৌলের আইসোটোপগুলো এমন অনুপাতে থাকে যে, এগুলোর ভরের গড় হিসেবে পারমাণবিক ভর পূর্ণসংখ্যার না হয়ে ভগ্নাংশ হয়। যেমন- ক্লোরিনের দুটি আইসোটোপ হলো
→ আপেক্ষিক আণবিক ভর : কোনো পদার্থের অণুতে বিদ্যমান পরমাণুসমূহের আপেক্ষিক পারমাণবিক ভরের সমষ্টিকে আপেক্ষিক আণবিক ভর বলা হয়। যেমন : অক্সিজেনের আপেক্ষিক পারমাণবিক ভর ১৬। একটি অক্সিজেন অণু অক্সিজেনের ২টি পরমাণু নিয়ে গঠিত। সুতরাং অক্সিজেনের আপেক্ষিক আণবিক ভর হবে ১৬ × ২ = ৩২।
→ পরমাণু পরিচিতি : কোনো পরমাণুর প্রতীকের বাম পাশে উপরের দিকে তার ভর সংখ্যা এবং বাম পাশে নিচের দিকে তার পারমাণবিক সংখ্যা লেখা হয়। যেমন:
→ তেজস্ক্রিয়তা : কিছু কিছু পদার্থ আছে যা থেকে আপনা-আপনি কিছু রশ্মি যেমন α (আলফা), β (বিটা), γ (গামা) অনবরত নির্গত হয়। এ ধরনের বিশেষ গুণবিশিষ্ট রশ্মিকে তেজস্ক্রিয় রশ্মি এবং যেসব পদার্থ থেকে এসব রশ্মি বের হয়, তাদের তেজস্ক্রিয় পদার্থ বলে। আর, তেজস্ক্রিয় পদার্থের এ ধরনের রশ্মি বিকিরণের বৈশিষ্ট্যকে তেজস্ক্রিয়তা বলে।
→ তেজস্ক্রিয় আইসোটোপ : প্রাকৃতিক ও কৃত্রিম উপায়ে তৈরি সুস্থিত ও অস্থিত আইসোটোপগুলোর মধ্যে অস্থিত আইসোটোপগুলো স্বতঃস্ফ‚র্তভাবে বিভিন্ন ধরনের রশ্মি বিকিরণ করে অন্য মৌলের আইসোটোপে পরিণত হয়। এই ধরনের আইসোটোপগুলোকে তেজস্ক্রিয় আইসোটোপ বলা হয়। প্রকৃতপক্ষে এসব মৌলের পরমাণুর নিউক্লিয়াসে পরিবর্তন ঘটে।
→ পরমাণুর মডেল : ১৯১১ সালে বিজ্ঞানী রাদারফোর্ড ও ১৯১৩ সালে বিজ্ঞানী নীলস বোর পরমাণুর গঠন বর্ণনা করার জন্য পরমাণু, মডেল প্রদান করেন।
→ রাদারফোর্ডের পরমাণু মডেল : বিজ্ঞানী রাদারফোর্ড ১৯১১ সালে আলফা কণা বিচ্ছুরণ পরীক্ষার সিদ্ধান্তের উপর ভিত্তি করে পরমাণুর গঠনকে একটি ক্ষুদ্র সৌরজগতের সঙ্গে তুলনা করেন। এ কারণে তাঁর প্রস্তাবিত পরমাণু মডেলকে পরমাণুর সৌর মডেলও বলা হয়। এর মূল বক্তব্য হলোÑ
১. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভ‚ত।
২. পরমাণু বিদ্যুৎ নিরপেক্ষ। অতএব, নিউক্লিয়াসের ধনাত্মক চার্জযুক্ত প্রোটন সংখ্যার সমান সংখ্যক ঋণাত্মক চার্জযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে।
৩. সৌরজগতের সূর্যের চারদিকে ঘূর্ণায়মান গ্রহসমূহের মতো পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসের চারদিকে অবিরাম ঘুরছে। ধনাত্মক চার্জ বিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জ বিশিষ্ট ইলেকট্রনসমূহের মধ্যে পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্রবহির্মুখী বল পরস্পর সমান।
→ বোর-এর পরমাণু মডেল : ১৯১৩ সালে নীলস বোর তাঁর বিখ্যাত পরমাণু মডেল প্রকাশ করেন। এ মডেলের স্বীকার্যসমূহ হলো :
১. নিউক্লিয়াসকে কেন্দ্র করে বৃত্তাকার পথে ইলেকট্রনসমূহ ঘুরতে থাকে।
২. নিউক্লিয়াসের চারদিকে বৃত্তাকার কতগুলো স্থির কক্ষপথ আছে যাতে অবস্থান নিয়ে ইলেকট্রনসমূহ ঘুরতে থাকে। এগুলোকে শক্তিস্তর বা অরবিট বলা হয়। শক্তিস্তরসমূহকে কল্পিত সংখ্যা হ-এর মান অনুসারে K, L, M, N দ্বারা প্রকাশ করা হয়। প্রথম শক্তিস্তরকে n = 1 (K শক্তিস্তর) ২য় শক্তিস্তরকে : n = 2 (L শক্তিস্তর) এভাবে n-এর মান 3, 4, 5 ইত্যাদি পূর্ণসংখ্যা মানে বৃদ্ধি পেতে থাকে এবং শক্তিস্তরসমূহকে যথাক্রমে M, N, O দ্বারা প্রকাশ করা যায়। একটি নির্দিষ্ট শক্তিস্তরে অবস্থানকালে ইলেকট্রনসমূহ শক্তি শোষণ অথবা বিকিরণ করে না।
৩. যখন কোনো ইলেকট্রন একটি নিম্নতর কক্ষপথ বা শক্তিস্তর যেমন n = 1 থেকে উচ্চতর কক্ষপথ n = 2 তে স্থানান্তরিত হয় তখন নির্দিষ্ট পরিমাণ শক্তি শোষণ করে। আবার, যখন কোনো উচ্চতর শক্তিস্তর যেমন n = 2 থেকে নিম্নতর কক্ষপথ n = 1 -এ স্থানান্তরিত হয় তখন শক্তি বিকিরণ করে।
→ পরমাণুতে ইলেকট্রন বিন্যাসের আধুনিক নিয়ম : পরমাণুতে নিউক্লিয়াসের চারদিকে কতগুলো কক্ষপথ বা শক্তিস্তর বা শেল থাকে, যাদের অরবিট বলা হয়। এদের নাম K, L, M, N, O, P ও Q ইত্যাদি।

K, L, M, N ইত্যাদি শক্তিস্তর আবার কতগুলো অরবিটাল বা উপশক্তিস্তরে বিভক্ত থাকে। যেমন :
ক শক্তিস্তরে বা ১ম শক্তিস্তরে ১টি উপশক্তিস্তর থাকে যার নাম ১ং
খ শক্তিস্তরে বা ২য় শক্তিস্তরে ২টি উপশক্তিস্তর থাকে যাদের নাম ২ং, ২ঢ়
গ শক্তিস্তরে বা ৩য় শক্তিস্তরে ৩টি উপশক্তিস্তর থাকে যাদের নাম ৩ং, ৩ঢ়, ৩ফ
ঘ বা ৪র্থ শক্তি স্তর থেকে শুরু করে উচ্চ শক্তিস্তর প্রত্যেকটিতে ৪টি করে উপশক্তিস্তর থাকে, যাদের নাম ৪ং, ৪ঢ়, ৪ফ, ৪ভ
অর্থাৎ, ং উপশক্তিস্তরে অরবিটাল ১টি, ঢ় উপশক্তিস্তরে অরবিটাল ৩টি, ফ উপশক্তিস্তরে অরবিটাল ৫টি, ভ উপশক্তিস্তরে অরবিটাল ৭টি।
প্রতিটি অরবিটালে সর্বোচ্চ ২টি ইলেকট্রন থাকতে পারে আবার ১টিও থাকতে পারে, নাও থাকতে পারে।
প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা ২হ২, যেখানে, হ = ১, ২, ৩, ৪ … ইত্যাদি। ২হ২ সূত্রানুসারেÑ
K শেলের ইলেকট্রন ধারণক্ষমতা, ২ × ১২ = ২টি
L শেলের ইলেকট্রন ধারণক্ষমতা, ২ × ২২ = ৮টি
M শেলের ইলেকট্রন ধারণক্ষমতা, ২ × ৩২ = ১৮টি
N শেলের ইলেকট্রন ধারণক্ষমতা, ২ × ৪২ = ৩২টি ইত্যাদি।
পরমাণুর ইলেকট্রন বিন্যাসের সময় ইলেকট্রনসমূহ বিভিন্ন অরবিটালে (উপশক্তিস্তরে) তাদের শক্তির নিম্নক্রম থেকে উচ্চতম অনুসারে প্রবেশ করে। স্থিতিশীলতা অর্জনের জন্য প্রথমে নিম্নশক্তি অরবিটালে ইলেকট্রন গমন করে এবং অরবিটাল পূর্ণ করে; এরপর ক্রমান্বয়ে উচ্চশক্তির অরবিটাল ইলেকট্রন দ্বারা পূর্ণ হয়। অরবিটালসমূহের শক্তিক্রম নিম্নরূপ :1s → 2s →2p →3s →3p →4s→3d →4p →5s →4d →5p →6s →4f →5d →6p →7s →5f →6d →7p →8s। এই নিয়মটি একটি ছকের মাধ্যমে দেখানো হলো :
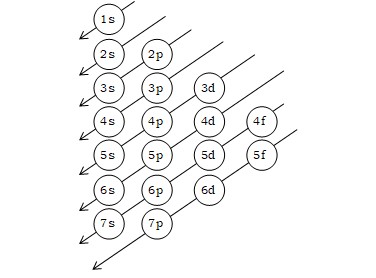
তবে, এই নিয়মের ব্যতিক্রমও আছে। অধিকাংশ ক্ষেত্রেই দেখা যায় যে,s, p, d, f অরবিটালগুলো অর্ধপূর্ণ বা পূর্ণরূপে ইলেকট্রন পেলে তারা অধিকতর স্থায়ী গঠন অর্জন করে। সুতরাং d10, s1, d5s1 ধরনের ইলেকট্রন বিন্যাস অধিকতর স্থায়ী।
তৃতীয় অধ্যায় পদার্থের গঠন জ্ঞানমূলক প্রশ্ন ও উত্তর
প্রশ্ন্ \ ১ \ নিউক্লিয়াসের চতুর্দিকে ঘূর্ণায়মান কণিকার নাম কী?
উত্তর : নিউক্লিয়াসের চতুর্দিকে ঘূর্ণায়মান কণিকার নাম ইলেকট্রন।
প্রশ্ন \ ২ \ মৌলিক কণিকা কাকে বলে?
উত্তর : যেসব অতি সূ² কণিকা দ্বারা পরমাণু গঠিত, তাদের মৌলিক কণিকা বলা হয়। এগুলো হলো ইলেকট্রন, প্রোটন ও নিউট্রন।
প্রশ্ন \ ৩ \ পরমাণুর নিউক্লিয়াস কী কী কণিকা দ্বারা গঠিত?
উত্তর : পরমাণুর নিউক্লিয়াস প্রোটন ও নিউট্রন নামক কণিকা দ্বারা গঠিত।
প্রশ্ন \ ৪ \ ইলেকট্রন পরমাণুর মধ্যে কোথায় অবস্থান করে?
উত্তর : ইলেকট্রন পরমাণুর মধ্যে নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষে বা শক্তিস্তরে অবস্থান করে।
প্রশ্ন \ ৫ \ নিউট্রনবিহীন একটি পরমাণুর নাম কর।
উত্তর : নিউট্রনবিহীন একটি পরমাণুর নাম হাইড্রোজেন।
প্রশ্ন \ ৬ \ মৌলের পরমাণু কয়টি মূল উপাদান দ্বারা গঠিত?
উত্তর : মৌলের পরমাণু ৩টি মূল উপাদান দ্বারা গঠিত।
প্রশ্ন \ ৭ \ প্রোটনের তড়িৎ আধানের প্রকৃতি কী?
উত্তর : প্রোটনের তড়িৎ আধানের প্রকৃতি হলো ধনাত্মক।
প্রশ্ন \ ৮ \ পদার্থের ক্ষুদ্রতম অবিভাজ্য কণাকে কী বলে?
উত্তর : পদার্থের ক্ষুদ্রতম অবিভাজ্য কণাকে পরমাণু বলে।
প্রশ্ন \ ৯ \ হাইড্রোজেন মৌলের আইসোটোপ কয়টি?
উত্তর: হাইড্রোজেন মৌলের আইসোটোপ তিনটি।
প্রশ্ন \ ১০ \ তেজস্ক্রিয় পদার্থ থেকে কী নির্গত হয়?
উত্তর : তেজস্ক্রিয় পদার্থ থেকে অনবরত স্বতঃস্ফ‚র্তভাবে তেজস্ক্রিয় রশ্মি নির্গত হয়।
প্রশ্ন \ ১১ \ তেজস্ক্রিয় পদার্থ থেকে কয়টি তেজস্ক্রিয় রশ্মি নির্গত হয়?
উত্তর : তেজস্ক্রিয় পদার্থ থেকে তিনটি তেজস্ক্রিয় রশ্মি নির্গত হয়।
প্রশ্ন \ ১২ \ পারমাণবিক সংখ্যা কম এমন একটি মৌলের তেজস্ক্রিয় আইসোটোপ উলেখ কর।
উত্তর : পারমাণবিক সংখ্যা কম এমন একটি মৌলের তেজস্ক্রিয় আইসোটোপ হলো ।
প্রশ্ন \ ১৩ \ কোন ভূতাত্তি¡ক বৈজ্ঞানিক গবেষণার কাজে আইসোটোপ ব্যবহৃত হয়?
উত্তর : কোটি কোটি বছর আগের পুরনো ফসিলের বয়স গণনায়
আইসোটোপ ব্যবহৃত হয়।
প্রশ্ন \ ১৪ \ চ পরমাণুর সবচেয়ে বাইরের কক্ষে কয়টি ইলেকট্রন আছে?
উত্তর : চ পরমাণুর সবচেয়ে বাইরের কক্ষে ৫টি ইলেকট্রন আছে।
প্রশ্ন \ ১৫ \ পরমাণুর তৃতীয় শক্তিস্তরে সর্বোচ্চ কতটি ইলেকট্রন থাকতে পারে?
উত্তর : পরমাণুর তৃতীয় শক্তিস্তরে সর্বোচ্চ ১৮টি ইলেকট্রন থাকতে পারে।
প্রশ্ন \ ১৬ \ একটি পরমাণুর আধানের প্রকৃতি কীরূপ?
উত্তর : একটি পরমাণু আধান নিরপেক্ষ।
প্রশ্ন \ ১৭ \ পরমাণুর নিজস্ব সত্ত¡া কী?
উত্তর : পরমাণুর প্রোটন সংখ্যাকে বলা হয় পারমাণবিক সংখ্যা যা একটি পরমাণুর নিজস্ব সত্ত¡া বা তার পরিচয়।
প্রশ্ন \ ১৮ \ অস্থিত আইসোটোপগুলো কী বিকিরণ করে?
উত্তর : অস্থিত আইসোটোপগুলো বিভিন্ন ধরনের রশ্মি α (আলফা), β (বিটা), γ (গামা) বিকিরণ করে।
প্রশ্ন \ ১৯ \ বর্ণালি কী?
উত্তর : বর্ণালি হলো বিভিন্ন বর্ণের আলোর সমাবেশ।
প্রশ্ন \ ২০ \ ƒ উপস্তরের সর্বোচ্চ ইলেকট্রন ধারণ-ক্ষমতা কত?
উত্তর : ƒ-উপস্থরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা ১৪টি।
প্রশ্ন \ ২১ \ স্ক্যান্ডিয়ামের সর্বশেষ ইলেকট্রনটি কোন অরবিটালে প্রবেশ করে?
উত্তর : স্ক্যান্ডিয়ামের সর্বশেষ ইলেকট্রনটি ৩ফ-অরবিটালে প্রবেশ করে।
প্রশ্ন \ ২২ \ ইলেকট্রনসূহের সাধারণ ধর্ম কী?
উত্তর : ইলেকট্রনসমূহের সাধারণ ধর্ম হচ্ছে এরা প্রথমে নিম্ন শক্তিসম্পন্ন উপস্তর পূর্ণ করে এবং ক্রমান্বয়ে উচ্চ শক্তিসম্পন্ন উপস্তরে গমন করে।
প্রশ্ন \ ২৩ \ প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা কোন সুত্র মেনে চলে?
উত্তর : প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা 2n2 সূত্র মেনে চলে।
প্রশ্ন \ ২৪ \ ক্যান্সার নিরাময়ে কোনটি দেওয়া হয়?
উত্তর : ক্যান্সার নিরাময়ে কেমোথেরাপি দেওয়া হয।
প্রশ্ন \ ২৫ \ গাইগার কাউন্টার কী?
উত্তর : যে যন্ত্রের সাহায্যে তেজস্ক্রিয় মৌল থেকে তেজস্ক্রিয় রশ্মি বা কণা শনাক্ত করা হয়, তাকে গাইগার কাউন্টার বলে।
তৃতীয় অধ্যায় পদার্থের গঠন অনুধাবনমূলক প্রশ্ন ও উত্তর
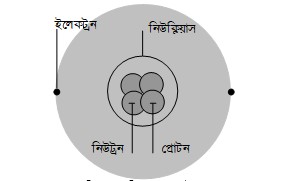
প্রশ্ন \ ১ \ একটি পরমাণুতে কোথায় কোথায় ইলেকট্রন, প্রোটন ও নিউট্রন থাকে তা চিত্র এঁকে দেখাও।
উত্তর : একটি পরমাণুতে ইলেকট্রন, প্রোটন ও নিউট্রন কীভাবে বিন্যস্ত থাকে তা নিচে দেখানো হলো :
প্রশ্ন \ ২ \ নাইট্রোজেনের পারমাণবিক সংখ্যা ৭। একটি নাইট্রোজেন পরমাণুর ইলেকট্রন বিন্যাস এঁকে দেখাও।
উত্তর : নাইট্রোজেনের পারমাণবিক সংখ্যা ৭। এর ইলেকট্রন বিন্যাস ২, ৫। নাইট্রোজেন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ :

প্রশ্ন \ ৩ \ পরমাণুর কোন কোন অংশে প্রোটন, নিউট্রন এবং ইলেকট্রন থাকে?
উত্তর : পরমাণুর নিউক্লিয়াসে থাকে প্রোটন ও নিউট্রন। আর ইলেকট্রন নিউক্লিয়াসের বাইরে চারদিকে ঘুরতে থাকে। ইলেকট্রন ঋণাত্মক চার্জযুক্ত, প্রোটন ধনাত্মক ও নিউট্রন চার্জ নিরপেক্ষ কণা। স্বাভাবিক অবস্থায় প্রত্যেক পরমাণুতে সমান সংখ্যক ইলেকট্রন ও প্রোটন থাকায় পরমাণু চার্জ নিরপেক্ষ হয়।
প্রশ্ন \ ৪ \ পরমাণু কি অবিভাজ্য?
উত্তর : রাসায়নিক বিক্রিয়ায় পরমাণুসমূহ অবিভাজ্য হিসেবেই থাকে অর্থাৎ পরমাণুকে ভাঙা যায় না। তবে বর্তমানে বিশেষ উপায়ে পরমাণুকে ভেঙে ইলেকট্রন, প্রোটন, নিউট্রনসহ আরও কয়েকটি মৌলিক কণা পাওয়া গেছে।
প্রশ্ন \ ৫ \ পারমাণবিক সংখ্যাকে মৌলের পরিচয় বলা হয় কেন?
উত্তর : পারমাণবিক সংখ্যা হলো, একটি নির্দিষ্ট সংখ্যা যা ঐ মৌলের পরমাণুতে বিদ্যমান প্রোটনের সংখ্যা। এটি ঐ মৌলের নিজস্ব ও স্বতন্ত্র ধর্ম যা অন্য কোনো মৌলের থাকে না বলেই একে মৌলের পরিচয় বলা হয়।
মৌলের পারমাণবিক সংখ্যা পরিবর্তিত হলে মৌলের মূল ধর্মের পরিবর্তন হয়। ফলে ওই মৌলের পরমাণু নতুন ধর্মবিশিষ্ট অন্য একটি মৌলের পরমাণুতে পরিণত হয়। অর্থাৎ দুটি বিভিন্ন মৌলের পারমাণবিক সংখ্যা কখনো সমান হয় না। এজন্য পারমাণবিক সংখ্যাকে মৌলের পরিচয় বলা হয়।
প্রশ্ন \ ৬ \ ভরসংখ্যা সব সময় একটি পূর্ণ সংখ্যা হয় কেন?
উত্তর : আমরা জানি, ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা। পরমাণুর নিউক্লিয়াসের মধ্যস্থ প্রোটন এবং নিউট্রন অবিভাজ্য। কাজেই পরমাণুর মধ্যে প্রোটন ও নিউট্রনের সমষ্টি কখনো ভগ্নাংশ হতে পারে না। এরা সব সময় পূর্ণ সংখ্যায় নিউক্লিয়াসে বর্তমান থাকে। একটি প্রোটনের ভরসংখ্যা ১ এবং একটি নিউট্রনের ভর একটি প্রোটনের ভরের প্রায় সমান। এ কারণে ভর সংখ্যা কখনো ভগ্নাংশ হয় না Ñ সর্বদা পূর্ণসংখ্যা হয়।
প্রশ্ন \ ৭ \ পরমাণুতে আইসোটোপের উৎপত্তি হয় কেন?
উত্তর : কোনো মৌলের বিভিন্ন পরমাণুর নিউক্লিয়াসে একই সংখ্যক প্রোটনের সঙ্গে ভিন্ন ভিন্ন সংখ্যক নিউট্রন থাকার জন্য পরমাণুগুলোর ভর বিভিন্ন হয়। ফলে আইসোটোপের উৎপত্তি হয়। মৌলের আইসোটোপগুলোতে পারমাণবিক সংখ্যা অর্থাৎ প্রোটন সংখ্যা একই কিন্তু ভর সংখ্যা বিভিন্ন হয়।
প্রশ্ন \ ৮ \ ভর সংখ্যা এবং পারমাণবিক সংখ্যার মধ্যে সম্পর্ক স্থাপন কর।
উত্তর : আমরা জানি,
ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা
যেহেতু, প্রোটন সংখ্যা = পারমাণবিক সংখ্যা
সুতরাং ভরসংখ্যা = পারমাণবিক সংখ্যা + নিউট্রন সংখ্যা
অতএব, পারমাণবিক সংখ্যা = ভরসংখ্যা – নিউট্রন সংখ্যা
এটাই ভর সংখ্যা এবং পারমাণবিক সংখ্যার মধ্যে সম্পর্ক।
প্রশ্ন \ ৯ \ পরমাণুর সঙ্গে ২টি প্রোটন এবং ২টি নিউট্রন যোগ করলে যদি ণ পরমাণুর সৃষ্টি হয় তবে ণ পরমাণুটিকে কীভাবে লিখবে? এর মধ্যে নিউট্রন সংখ্যা কত হবে?
উত্তর : পরমাণুর সঙ্গে ২টি প্রোটন এবং ২টি নিউট্রন যোগ করলে এর পারমাণবিক সংখ্যা হয় = (৯০ + ২) = ৯২ এবং ভরসংখ্যা = (২৩৪ + ২ + ২) = ২৩৮ হবে। সুতরাং ণ পরমাণুটির সংকেত
হবে।
প্রশ্ন \ ১০ \ ক্লোরিন পরমাণুর ভর সংখ্যা ৩৫ এবং প্রোটন সংখ্যা ১৭। পরমাণুটির ২টি নিউট্রন যুক্ত হলে কী পরিবর্তন ঘটবে?
উত্তর : Cl পরমাণুর সঙ্গে ২টি নিউট্রন যুক্ত হলে এর প্রোটন সংখ্যা তথা পারমাণবিক সংখ্যা একই থাকবে, কিন্তু ভর সংখ্যা ২ বেড়ে যাবে। অর্থাৎ এর ভরসংখ্যা = ৩৫ + ২ = ৩৭ হবে। ক্লোরিনের একটি আইসোটোপ উৎপন্ন হবে।
প্রশ্ন \ ১১ \ একটি পরমাণুর K কক্ষে ২টি, L কক্ষে ৮টি এবং M কক্ষে ১টি ইলেকট্রন আছে। পরমাণুটির পারমাণবিক সংখ্যা কত?
উত্তর : পরমাণুর বাইরের কক্ষে মোট ইলেকট্রন সংখ্যা = ২ + ৮ + ১ = ১১
মোট প্রোটন সংখ্যা = ১১ এবং পারমাণবিক সংখ্যা = ১১
প্রশ্ন \ ১২ \ কার্বনের পারমাণবিক সংখ্যা ও ভরসংখ্যা যথাক্রমে ৬ এবং ১২ হলে কার্বন পরমাণুর গঠন সম্পর্কে আলোচনা কর।
উত্তর : পারমাণবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা। যেহেতু কার্বনের পারমাণবিক সংখ্যা = ৬, সুতরাং কার্বন পরমাণুতে প্রোটন সংখ্যা = ৬, ইলেকট্রন সংখ্যা ৬। আবার নিউট্রন সংখ্যা = ভরসংখ্যা Ñ পারমাণবিক সংখ্যা = ১২ ৬ = ৬। যেহেতু পরমাণুর নিউক্লিয়াসে প্রোটন এবং নিউট্রন থাকে। সুতরাং কার্বন পরমাণুর নিউক্লিয়াসে ৬টি প্রোটন এবং ৬টি নিউট্রন থাকে। আবার কার্বন পরমাণুর মধ্যে ৬টি ইলেকট্রন বর্তমান, কাজেই এ ৬টি ইলেকট্রন নিউক্লিয়াসের বাইরে বিভিন্ন কক্ষে আবর্তন করে।
প্রশ্ন \ ১৩ \ কোনো মৌলের একটি পরমাণুতে ১১টি প্রোটন এবং ১২টি নিউট্রন আছে। মৌলটির ভরসংখ্যা, পারমাণবিক সংখ্যা এবং ইলেকট্রন সংখ্যা নির্ণয় কর।
উত্তর : পরমাণুর ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা = ১১ + ১২ = ২৩, আবার পারমাণবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা।
যেহেতু প্রোটন সংখ্যা = ১১, সুতরাং পারমাণবিক সংখ্যা = ১১, ইলেকট্রন সংখ্যা = ১১।
প্রশ্ন \ ১৪ \ একটি মৌলের ভরসংখ্যা ২৭ এবং পারমাণবিক সংখ্যা ১৩। এর নিউক্লিয়াসে কয়টি প্রোটন ও কয়টি নিউট্রন আছে?
উত্তর : আমরা জানি, ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রন সংখ্যা। আবার, পারমাণবিক সংখ্যা = প্রোটন সংখ্যা।
প্রোটন সংখ্যা = ১৩ এবং নিউট্রন সংখ্যা = ভরসংখ্যা Ñ প্রোটন সংখ্যা = ২৭ – ১৩ = ১৪।
সুতরাং, মৌলটির নিউক্লিয়াসে ৬টি প্রোটন ও ৬টি নিউট্রন আছে।
প্রশ্ন \ ১৫ \ ৩২১৫চ আইসোটোপ কী বিশেষ কাজে ব্যবহার করা হয়?
উত্তর : আইসোটোপ কৃষিক্ষেত্রে পতঙ্গ নিয়ন্ত্রণে ব্যবহার করা হয়। এছাড়া কখন, কোন সার, কী পরিমাণ ব্যবহার করতে হবে তা জানতেও এই আইসোটোপ ব্যবহার করা হয়।
প্রশ্ন \ ১৬ \ গামা রশ্মি কী কাজে ব্যবহৃত হয়?
উত্তর : গামা রশ্মি ব্যাকটেরিয়াসহ অনেক জীবাণু ধ্বংসে ব্যবহৃত হয়। খাদ্যদ্রব্য বা ফলমূল সংরক্ষণের সময় যেন ব্যাকটেরিয়া আক্রমণ করতে না পারে সেজন্য মূলত এই রশ্মি ব্যবহৃত হয়।
প্রশ্ন \ ১৭ \ দুটি মৌল A এবং B এর পারমাণবিক সংখ্যা যথাক্রমে ১১ এবং ১৭। ইলেকট্রন বিন্যাস লিখে এই মৌলদ্বয় শনাক্ত কর।
উত্তর : A মৌলের পারমাণবিক সংখ্যা ১১ অর্থাৎ এর ইলেকট্রন বিন্যাস ২, ৮, ১। সুতরাং মৌলটির নাম Na। B মৌলের পারমাণবিক সংখ্যা ১৭ অর্থাৎ এর ইলেকট্রন বিন্যাস ২, ৮, ৭। সুতরাং মৌলটির নাম Cl।
প্রশ্ন \ ১৮ \ একটি পরমাণুর প্রথম কক্ষে ২টি, দ্বিতীয় কক্ষে ৮টি এবং তৃতীয় কক্ষে ৩টি ইলেকট্রন আছে মৌলটি শনাক্ত কর।
উত্তর : ২, ৮, ৩ ইলেকট্রন বিন্যাস সমৃদ্ধ মৌলটি হলো অ্যালুমিনিয়াম।
প্রশ্ন \ ১৯ \ কী কারণে আইসোটোপগুলো একটি থেকে অন্যটি ভিন্ন হয়?
উত্তর : আইসোটোপগুলোর পারমাণবিক সংখ্যা অর্থাৎ প্রোটন সংখ্যা একই কিন্তু নিউক্লিয়াসে নিউট্রন সংখ্যা বিভিন্ন হওয়ায় ভিন্ন ভরবিশিষ্ট আইসোটোপের পরমাণু পাওয়া যায়। এ কারণে আইসোটোপগুলো একটি থেকে অন্যটি ভিন্ন হয়।
প্রশ্ন \ ২০ \ অক্সিজেনের ভর সংখ্যা ১৬ বলতে কী বোঝায়?
উত্তর : অক্সিজেনের ভর সংখ্যা ১৬ বলতে বোঝায় যে, অক্সিজেন পরমাণুর নিউক্লিয়াসে মোট ১৬টি প্রোটন ও নিউট্রন আছে।
প্রশ্ন \ ২১ \ সোডিয়ামের পারমাণবিক সংখ্যা ১১ বলতে কী বোঝ?
উত্তর : সোডিয়ামের পারমাণবিক সংখ্যা ১১ বলতে বোঝায় যে, সোডিয়াম পরমাণুর নিউক্লিয়াসে ১১টি প্রোটন আছে।
প্রশ্ন \ ২২ \ বর্ণালি বলতে কী বোঝ?
উত্তর : বর্ণালি হলো বিভিন্ন বর্ণর আলোর সমাবেশ।
কক্ষপথ থেকে ইলেকট্রন স্থানান্তরের সময় বিকিরিত ও শোষিত শক্তিকে বর্ণালি হিসেবে পাওয়া যায়। বৃষ্টির পর আকাশে সূর্যের বিপরীত পাশে বর্ণালি দেখা যায়। এই বর্ণালিও পরমাণু থেকে প্রাপ্ত বর্ণালি দেখতে একই রকম।
প্রশ্ন \ ২৩ \ অরবিটালসমূহের শক্তিক্রম কীরূপ?
উত্তর : পরমাণুর ইলেকট্রন বিন্যাসের সময় ইলেকট্রনসমূহ বিভিন্ন অরবিটালে (উপ-শক্তিস্তরে) তাদের শক্তির নিম্রক্রম থেকে উচ্চক্রম অনুসারে প্রবেশ করে। স্থিতিশীলতা অর্জনের জন্য প্রথমে নিম্নশক্তির অরবিটালে ইলেকট্রন গমন করে এবং অরবিটাল পূর্ণ করে। এভাবে, ক্রমান্বয়ে উচ্চ শক্তির অরবিটাল ইলেকট্রন দ্বারা পূর্ণ হয়। অরবিটালসমূহের শক্তিক্রম নিম্নরূপ:
1s < 2s 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p < 8s
প্রশ্ন \ ২৪ \ কোন কোন ইলেকট্রন বিন্যাস বিশিষ্ট মৌল অধিকতর স্থায়ী হয়?
উত্তর : সাধারণভাবে দেখা যায় যে, সমশক্তিসম্পন্ন অরবিটালসমূহ অর্ধপূর্ণ বা সম্পূর্ণরূপে পূর্ণ হলে সে ইলেকট্রন বিন্যাস অধিকতর সুস্থিতি অর্জন করে।
সুতরাং, np3, np6, ns1, ns2, nd5, nd10, nf7 এবং nf14 সবচেয়ে সুস্থিত হয়। যার দরুণ d10s1 এবং d5s1 ইলেকট্রন বিন্যাসবিশিষ্ট মৌল অধিকতর স্থায়ী হয়।
প্রশ্ন \ ২৫ \ তেজস্ক্রিয় আইসোটোপের বহুমুখী ব্যবহার লিখ।
উত্তর : তেজস্ক্রিয় আইসোটোপ কীটপতঙ্গ নিয়ন্ত্রণে, শিল্পক্ষেত্রে, ধাতব পাত্রের পুরুত্ব পরিমাপে, বদ্ধপাত্রে তরলের উচ্চতা পরিমাপে, পাইপ লাইনের ছিদ্র অন্বেষণে প্রভৃতি কাজে ব্যবহার করা হয়।
এছাড়া, ফসিল মমিসহ পৃথিবীর যাবতীয় বস্তুর বয়স, এমনকি পৃথিবীর বয়স নির্ধারণে তেজস্ক্রিয় আইসোটোপ (14C) ব্যবহৃত হয়।


