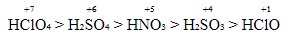আমরা অনেকেই দুর্বল এসিড ও শক্তিশালী এসিড চিনতে ভূল করি। আজাকের এই পোস্টের মাধ্যমে আমরা দুর্বল এসিড ও শক্তিশালী এসিড চেনার সকল কৌশল জানবো।
আমরা ৫টি নিয়মের মাধ্যমে শক্তিশালী এসিডের ক্রম জানবো।
নিয়ম-১ঃ দুর্বল এসিড জলীয় দ্রবনে আংশিক আয়নিত হয় অপরপক্ষে শক্তিশালী এসিড জলীয় দ্রবনে সম্পূর্ণ আয়নিত হয়।
যেমনঃ i) HCl একটি শক্তিশালী এসিড। কারণ HCl জলীয় দ্রবনে সম্পূর্ণ আয়নিত হয়।
HCl (জলীয়) → H⁺ + Cl⁻ (১০০% আয়নিত হয়)
ii) H₂CO₃ (কার্বনিক এসিড) একটি দুর্বল এসিড, কারণ এটি জলীয় দ্রবনে আংশিক আয়নিত হয়।
H₂CO₃ (জলীয়) → 2H⁺ + CO₃²⁻ (আংশিক আয়নিত হয়)
নিয়ম-২ঃ হ্যালোজেন এসিডের তীব্রতা নির্ভর করে, হ্যালোজেনের আকারের উপর। যে হ্যালোজেন এসিডের ক্ষেত্রে, হ্যালোজেনের (ঋণাত্মক আয়ন) আকার যত বড় হবে,সে হ্যালোজেন এসিড তত শক্তিশালী হবে।
বিশ্লেষণঃ HI, HBr, HCl, ও HF এর মধ্যে কোনটি শক্তিশালী এসিড ও কোনটি দুর্বল এসিড?
আমরা জানি, F, Cl, Br, ও I প্রভৃতি হ্যালোজেন গুলোর মধ্যে I এর আকার সবচেয়ে বড় এবং F আকার সবচেয়ে ছোট।
অর্থাৎ এদের তীব্রতার ক্রম হলো I > Br > Cl > F
সুতরাং নিয়ম অনুযায়ী I (আয়োডিন) এর আকার বড় হওয়ায় HI এসিড সবচেয়ে শক্তিশালী এসিড হবে।
অপরপক্ষে F এর আকার সবচেয়ে ছোট হওয়ায় HF এসিড সবাচেয়ে দুর্বল এসিড হবে।
সুতরাং হ্যালোজেন এসিডের তীব্রতার ক্রম হবে নিম্নরুপঃ
HI > HBr > HCl > HF
মনে রেখো ঃ F, Cl, Br, I কে হ্যালোজেন মৌল বলে।
নিয়ম-৩ঃ অক্সো এসিডের কেন্দ্রিয় পরমানুর ধনাত্মক জারন সংখ্যা যত বৃদ্ধি পাবে এসিডটি তত শক্তিশালী হবে।
যে সব এসিড অক্সিজেন পরমাণু (O) দিয়ে গঠিত হয় তাদেরকে অক্সো এসিড বলে।
বিশ্লেষণঃ HClO₄, H₂SO₄, HNO₃, H₂SO₃, HClO এসিডগুলির মধ্যে কোনটি শক্তিশালী এবং কোনটি দুর্বল এসিড দেখা যাক।
HClO₄ এসিডে কেন্দ্রিয় পরমানুটি হলো = Cl
এখানে Cl এর জারন সংখ্যা বের করা যাক
মনেকরি Cl এর জারনসংখ্যা = x
∴ নিয়ম অনুযায়ী –
+1 + x + (-2×4) = 0
বা, x = +8-1
∴ x = +7
∴ Cl এর জারন মান = +7
অনুরুপভাবে,
- H₂SO₄ এর কেন্দ্রিয় পরমানু S এর জারনসংখ্য = +6
- HNO₃ এর কেন্দ্রিয় পরমানু N এর জারনসংখ্য = +5
- H₂SO₃ এর কেন্দ্রিয় পরমানু S এর জারনসংখ্য = +4
- HClO এর কেন্দ্রিয় পরমানু Cl এর জারনসংখ্য = +1
আমরা দেখতে পাচ্ছি HClO₄ এর কেন্দ্রিয় পরমানু Cl এর ধনাত্মক জারনমান সবচেয়ে বেশী অর্থাৎ +7
সুতারাং HClO₄ (পারক্লোরিক এসিড) হবে সবচেয়ে শক্তিশাল এসিড।
অপরপক্ষে HClO এর কেন্দ্রিয় পরমানু Cl এর জারন মান সবচেয়ে কম অর্থাৎ +1 হওয়ায় HClO (হাইপোক্লোরাস এসিড) হবে সবচেয়ে দুর্বল এসিড।
পরিশেষে আমার এসিডগুলির তীব্রতার ক্রম নিম্নরুপে লিখতে পারি।
নিয়ম -৪ঃ অক্সো এসিড সমূহের কেন্দ্রিয় পরমানুর ধনাত্মক জারন মান যদি একই হয়, তখন যে অক্সোএসিডে কেন্দ্রিয় পরমানুর আকার ছোট হবে সে অক্সোএসিডটি শক্তিশালী হবে।
বিশ্লেষণ ঃ HNO₃ ও H₃PO₄ এসিড দুটির মধ্যে কোনটি তীব্র এসিড লেখা যাক।
এখানে HNO₃ এর কেন্দ্রিয় পরমানু N এর জারনমান = +5
H₃PO₄ এর কেন্দ্রিয় পরমানু P এর জারনমান = +5
দেখা যাচ্ছে দুটি এসিডের কেন্দ্রিয় পরমানুর ধনাত্মক জারন মান সমান।
কিন্তু আমরা জানি, N পরমানুর আকার P পরমানুর চেয়ে ছোট
সুতারাং HNO₃ এসিড তীব্রতার এসিড হবে।
অর্থাৎ HNO₃ > H₃PO₄
নিয়ম-৫ঃ i) জলীয় দ্রবনে যে এসিডের বিয়োজন ধ্রুবক (ka) এর মান যত বেশী, সে এসিড তত বেশী শক্তিশালী হবে।
ii) আবার যে এসিডের বিয়োজন ধ্রুবক Pka এর মান যত বেশী ঋনাত্মক হবে, সে এসিড তত বেশী শক্তিশালী হবে।
iii) যে এসিডের বন্ধন বিয়োজন এনথালপি যত কম হবে, সে এসিডটি তত বেশী শক্তিশালী হবে।
বিশ্লেষণঃ HI, HBr, HCl, ও HF এর তীব্রতা দেখা যাকঃ
|
|
HF |
HCl |
HBr |
HI |
|
বন্ধন বিয়োজন এনথালপি |
+560 |
+430 |
+370 |
+300 |
|
বিয়োজন ধ্রুবক Pka |
3.25 |
-7.5 |
-9.5 |
-10 |
|
বিয়োজন ধ্রুবক ka |
5.6×10⁻⁴ |
|
|
|
উপরের তথ্যের প্রেক্ষিতে আমরা এসিডগুলির তীব্রতার ক্রম লিখতে পারিঃ
HI > HBr > HCl > HF
এই পোস্টটি যে সম্পর্কেঃ
দুর্বল এসিড ও শক্তিশালী এসিড চেনার সহজ উপায়। সবচেয়ে শক্তিশালী এসিড কোনটি। সবল এসিড চেনার উপায়। একটি তীব্র এসিড এর নাম। তীব্র এসিড কাকে বলে ও উদাহরণ।