নবম শ্রেণির রসায়ন ৫ম সপ্তাহের অ্যাসাইনমেন্ট ২০২২ পোস্টে সকল শিক্ষার্থীদের স্বাগতম। আজ আমরা তোমাদের ৫ম সপ্তাহের রাসয়ন অ্যাসাইনমেন্ট ৯ম শ্রেণি প্রদান করবো।
তোমরা যদি করোনাকালীন সময়ে তোমাদের বাসায় রসায়ন বিজ্ঞান ভালো করে পড়ে থাকো তাহলে তোমাদের এই অ্যাসাইনমেন্ট লিখতে সমস্যা হবেনা। আর যারা রাসয়ন বিষয়টি ভালো করে পড়েছো তাদের জন্য আজকের ৫ম সপ্তাহের রসায়ন এসাইনমেন্টটি সহজ হতে চলেছে।
রসায়ন ৫ম সপ্তাহ অ্যাসাইনমেন্ট ২০২২ এর উত্তর লেখার আগে তোমরা নিশ্চয় প্রশ্নগুলো পড়ে নিতে চাইবে। তোমাদের অনেকের বিদ্যালয় থেকে হয়তো এখনো ৫ম সপ্তাহের অ্যাসাইনমেন্ট প্রশ্নগুলে দেয়নি। কিন্তু এটা নিয়ে তোমাদের কোনো চিন্তা নাই। আমরা তোমদের অ্যাসাইনমেন্ট লেখার সুবিধার্তে এখানে ৯ম শ্রেণির ৫ম সপ্তাহের রসায়ন অ্যাসাইনমেন্ট ২০২২ এর প্রশ্নগুলো প্রদান করবো। নিচের দেওয়া প্রশ্নটি তোমরা জুম করে পড়ে নাও।
৯ম শ্রেণির রসায়ন ৫ম সপ্তাহের অ্যাসাইনমেন্ট ২০২২ প্রশ্ন

উপরের প্রশ্নগুলে পড়ে তোমরা বুঝতেই পারছো ৫ম সপ্তাহে তোমাদের যে রসায়ন প্রশ্ন দেওয়া হয়েছে তা অনেক সহজ ও মজাদার। এখানে তামাদের পটাশিয়াম ও অক্সিজেন দিয়ে যৌগ গঠন করতে হবে, ইলেকট্রন বিন্যাস করতে হবে। এদের যৌগ ডায়াগ্রাম চিত্র একে দেখাতে হবে। সেই সাথে এটির পোলার দ্রাবকে দ্রবণীয়তা দেখাতে হবে। চলো আমরা নিচে এই প্রশ্নগুলোর উত্তর দেখে নিই।
নবম শ্রেণির রসায়ন ৫ম সপ্তাহের অ্যাসাইনমেন্ট ২০২২ সমাধান
অ্যাসাইনমেন্ট শুরু
”ক” প্রশ্নের উত্তর
চারটি শক্তিস্তর আছে এবং শেষ শক্তিস্তরে একটি ইলেকটন আছে এমন মৌলের ইলেকট্রন বিন্যাস হচ্ছে 2,8,8,1
অর্থাৎ মৌলটি হচ্ছে পটাশিয়াম (K)
এবং দুইটি শক্তিস্তর আছে এবং শেষ শক্তিস্তরে ৬টি ইলেকট্রন থকালে তার ইলেকট্রন বিন্যাস হবে 2,6
অর্থাৎ মৌলটি হচ্ছে অক্সিজেন (O)
”খ” প্রশ্নের উত্তর
অক্সিজেন (O) ও পটাশিয়াম (K) মৌল দুটির পর্যায় সারণিতে অবস্থানঃ
পটাশিয়ামের (K) ইলেকট্রন বিন্যাস নিন্মরুপঃ
K(19) = 1s22s22p63s23p64s1
পটাশিয়ামের ইলেকট্রন বিন্যাস থেকে বলা যায় পটাশিয়ামের অবস্থান ৪র্থ পর্যায়ের ১ম গ্রুপে।
অক্সিজেনের (O) ইলেকট্রন বিন্যাস নিম্নরুপঃ
O(8) = 1s22s22p4
অক্সিজেনের ইলেকট্রন বিন্যাস থেকে বলা যায় অক্সিজেনের অবস্থান ২য় পর্যায়ের ১৬ নং গ্রুপে।
”গ” প্রশ্নের উত্তর
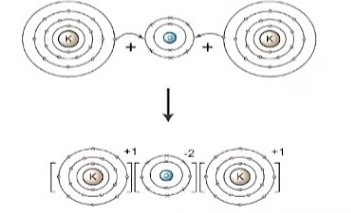
উদ্দীপকে উল্লেখিত মৌল দুটি হল পটাশিয়াম এবং অক্সিজেন।মৌল দুইটির ইলেকট্রন বিন্যাসের মাধ্যমে জানা যায় যে পটাশিয়াম ধাতু এবং অক্সিজেন অধাতু।বন্ধন গঠনকালে পটাশিয়াম তার সর্ববহিঃস্থ স্তরের একটি ইলেকট্রন দান করে
ধনাত্মক আয়নে পরিণত হয় এরং পটাশিয়াম তার নিকটবর্তী নিষ্ক্রিয় আর্গন গ্যাসের ইলেকট্রন কাঠামো অর্জন করে অপরদিকে একটি অক্সিজেন দুটি ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয়। এবং তার নিকটবর্তী নিষ্ক্রিয় নিয়ন গ্যাসের ইলেকট্রন কাঠামো অর্জন করে। ধনাত্মক আধান বিশিষ্ট পটাশিয়াম এবং ঋণাত্মক আধান বিশিষ্ট অক্সিজেনের সাথে আয়নিক বন্ধন বিশিষ্ট
পটাশিয়াম অক্সাইড যৌগ গঠন করে।
রাসয়নিক বিক্রয়াঃ
4K → 4K++4e–
O2 + 4e– → 2O2-
4k+O2 → 2K2O
ডায়াগ্রাম চিত্রের সাহায্যে দেখানো হলো
“ঘ” প্রশ্নের উত্তর
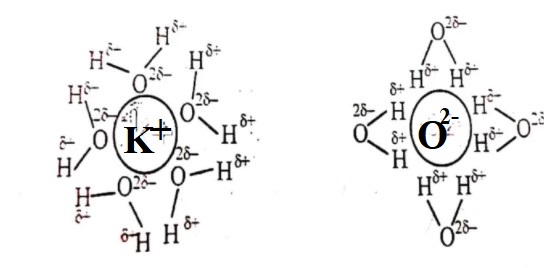
আমরা জানি, আয়নিক যৌগ কিভাবে পানিতে দ্রবীভূত হয়, যেহেতু পটাশিয়াম অক্সাইড একটি আয়নিক যৌগ।সুতরাংএটি পানিতে দ্রবীভূত হবে।
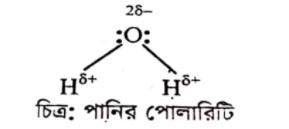
পানির অণুতে অক্সিজেন ও হাইড্রোজেন পরমাণুর মধ্যবর্তী শেয়ারকৃত ইলেকট্রনকে উভয় পরমাণুর নিউক্লিয়াস আকর্ষণ করে।এই আকর্ষণ করার ক্ষমতা H পরমাণুর তুলনায় O পরমাণুর বেশি থাকে। যার ফলে অক্সিজেন আংশিক ঋণাত্মক প্রান্তে ও হাইড্রোজেন আংশিক ধনাত্মক প্রান্তে পরিণত হয়।
K2O আয়নিক যৌগে ধনাত্মক K+ ও খনাত্বক O2- প্রান্ত থাকে। ধনাত্মক K+ প্রান্ত পানির O2- প্রান্ত দ্বারা আকর্ষিত হয় এবং ঋনাত্বক O2- প্রান্ত পানির ধনাত্মক H+ প্রান্ত দ্বারা আকর্ষিত হয়।আকর্ষণের কারণে K2O এর ধনাত্মক ও ঋনাত্বক প্রান্ত পরস্পর থেকে বিচ্ছিন্ন হয়ে পানির পোলার অণুর বিপরীত প্রান্ত দ্বারা পরিবেষ্টিত থাকে ‘এবংপানিতে দ্রবীভূত হয়।
অ্যাসাইনমেন্ট শেষ
উপরের অ্যাসাইনমেন্ট উত্তরটি তোমাদের ভালে লাগলে তোমরা কমেন্টে একটি ধন্যবাদ জানিও। সেই সাথে আমাদের ফেজবুক পেজে একটি লাইক দিয়ে রাখো যাতে তোমরা অ্যাসাইনমেন্ট উত্তরগুলো পেয়ে যাবে।
আরো পড়ুনঃ
⇒ সকল সপ্তাহের সকল অ্যাসাইনমেন্ট
⇒ ৯ম শ্রেণির ৫ম সপ্তাহের ইংরেজি অ্যাসাইনমেন্ট
⇒ ৯ম শ্রেণির ৫ম সপ্তাহের রসায়ন অ্যাসাইনমেন্ট
⇒ ৯ম শ্রেণির ৫ম সপ্তাহের ব্যবসায় উদ্যোগ অ্যাসাইনমেন্ট
⇒ ৯ম শ্রেণির ৫ম সপ্তাহের ভূগোল ও পরিবেশ অ্যাসাইনমেন্ট
⇒ ১০ম শ্রেণির ৫ম সপ্তাহের ইংরেজি অ্যাসাইনমেন্ট
⇒ ১০ম শ্রেণির ৫ম সপ্তাহের রসায়ন অ্যাসাইনমেন্ট
⇒ ১০ম শ্রেণির ৫ম সপ্তাহের ব্যবসায় উদ্যোগ অ্যাসাইনমেন্ট
⇒ ১০ম শ্রেণির ৫ম সপ্তাহের ভূগোল ও পরিবেশ অ্যাসাইনমেন্ট
